Il y a un esprit et un but derrière l'univers. Il y a des conseils de cette présence divine dans la façon dont les mathématiques abstraites peuvent pénétrer les secrets de l'univers, et qui suggère qu'un esprit rationnel ait créé le monde. La nature est accordée avec finesse pour permettre à la vie et à la conscience de se former.84
Jusqu'ici, nous avons examiné comment les équilibres physiques de l'univers ont été conçus de sorte à ce que nous puissions y vivre. Nous avons vu comment la structure générale de cet univers, la position de la Terre ainsi que des facteurs tels que l'air, la lumière et l'eau, ont été conçus avec telle précision, qu'ils possèdent les attributs exacts que nous exigeons. Cependant, en plus de tout cela, nous devons également jeter un coup d'œil aux éléments qui composent notre corps. Ces éléments chimiques, cette "ossature" de laquelle proviennent nos mains, nos yeux, nos cheveux, nos organes ainsi que toutes les espèces vivantes (animale et végétale) –qui sont du reste notre source de nourriture– ont tous été créés pour incarner spécialement leur fonction.
Le physicien Robert E. D. Clark se réfère à cette conception supérieure des éléments qui constituent la base de la vie quand il dit : "Le créateur nous a donné un kit de pièces préfabriquées prêtes à l'utilisation."85
Le plus important des ces éléments constitutifs de base est le carbone.

Une des formes naturelles du carbone pur se nomme le graphite. Cet élément est capable de transformer une variété extraordinaire de substances différentes quand il se combine avec des atomes d'autres éléments. La structure principale du corps humain est le résultat de différentes liaisons chimiques dans lesquelles le carbone a pu entrer.
Dans les chapitres précédents, nous avons décrit le processus extraordinaire par lequel le carbone, l'élément qui occupe la sixième position dans la table périodique, a été créé aux cœurs des énormes étoiles appelées "géants rouges". Nous avons également vu que Fred Hoyle, en découvrant ce processus merveilleux, a souligné que "Les lois de la physique nucléaire ont été délibérément conçues quand il s'agit des conséquences qu'elles produisent à l'intérieur des étoiles.".86
Quand nous examinons le carbone d'une manière plus approfondie, nous pouvons voir que non seulement la formation physique de cet élément mais également ses propriétés chimiques ont été délibérément arrangées pour devenir ce qu'elles sont.
Le carbone pur se produit à l'état naturel sous deux formes : Le graphite et les diamants. De plus, le carbone se trouve mélangé au sein de composés dont le résultat peut produire plusieurs différents genres de substances. Une incroyable variété de matériaux organiques de la vie dont, entre autres, la cellule et l'écorce d'un arbre, la pupille d'un œil et la corne d'un cerf, le blanc d'œuf et le poison d'un serpent, se composent tous à partir de composés à base de carbone. Le carbone, combiné de différentes manières (quantité et agencements géométriques) avec de l'hydrogène, de l'oxygène et de l'azote, résulte en un vaste assortiment de matériaux aux propriétés fortement différentes.
Certaines molécules de certains composés de carbone se composent de quelques atomes ; d'autres en contiennent des milliers ou même des millions. En outre, aucun autre élément n'est aussi versatile que le carbone pour la formation de molécules d'une telle longévité et stabilité. David Burnie en parle ainsi dans son livre Life :
Le carbone est un élément très peu commun. Sans la présence du carbone et de ses propriétés peu communes, il est peu probable qu'il y aurait vie sur Terre87
Le chimiste britannique Nevil Sidgwick écrivit le suivant concernant le carbone dans Chemical Elements and their Compounds :
Le carbone a un statut unique parmi les éléments en ce qui concerne son nombre et la variété de composés qu'il peut former. Plus d'un quart de millions ont déjà été isolés et décrits, mais ceci donne une idée très imparfaite de son pouvoir, puisqu'il est la base de toutes les formes de matière vivante. 88
Pour des raisons physiques et chimiques, la vie ne peut être basée sur aucun autre élément que le carbone. A un certain moment, on a avancé l'hypothèse que le silicium, parmi tant d'autres, pourrait être à la base de la vie. Cependant, nous savons maintenant que cette conjecture est impossible. Citons Sidgwick à nouveau :
Maintenant, nous en savons assez pour être sûrs que l'idée d'un monde basé sur le silicium à la place du carbone est impossible...89
Les liaisons chimiques grâce auxquelles le carbone forme les composés organiques s'appellent "les liens covalents". On dit communément qu'il existe un lien covalent lorsque deux atomes partagent leurs électrons.
Les électrons d'un atome se trouvent dans des orbites spécifiques qui sont centrés sur le noyau. L'orbite la plus proche du noyau ne peut pas être occupée par plus de deux électrons. Dans l'orbite suivante, un maximum de huit électrons est possible. Dans la troisième orbite, il peut y avoir jusqu'à dix-huit électrons. Le nombre d'électrons continue à augmenter plus il existe d'orbites. Un aspect intéressant de cet arrangement est que les atomes semblent "vouloir" compléter le nombre d'électrons au sein de leurs orbites spécifiques. L'oxygène, par exemple, a six électrons dans sa deuxième (et extérieure) orbite. Ceci le rend "désireux" d'entrer dans des combinaisons avec d'autres atomes qui fourniront les deux électrons supplémentaires nécessaires pour augmenter ce nombre à huit. (La raison pour laquelle les atomes se comportent de cette manière est toujours sans réponse. Mais ce qu'ils font est bénéfique car sinon la vie serait impossible.)
Les liens covalents sont le résultat de cette tendance que les atomes ont à compléter leurs orbites spécifiques. Deux atomes ou plus peuvent souvent combler le déficit de leurs orbites en partageant des électrons entre eux. Un bon exemple est celui de la molécule d'eau (H2O), dont les éléments de base (deux atomes d'hydrogène et un atome d'oxygène) forment un lien covalent. Dans ce composé, l'oxygène complète le nombre d'électrons manquant de sa deuxième orbite (de 6 à 8) en partageant les deux électrons (un pour chacun) dans les orbites spécifiques des deux atomes d'hydrogène ; de la même manière, chaque atome d'hydrogène "emprunte" un électron à l'oxygène pour compléter ses propres orbites spécifiques.
Comme le carbone est propice à la formation de liens covalents avec d'autres atomes (y compris les atomes de carbone), il en résulte un grand nombre de différents composés. Un des composés les plus simples est le méthane : Un gaz banal qui est formé suite à la liaison covalente de quatre atomes d'hydrogène et d'un atome de carbone. Avec seulement six électrons, l'orbite spécifique externe du carbone a besoin de quatre électrons supplémentaires (au lieu de deux lorsqu'il s'agit de l'oxygène) pour atteindre huit.
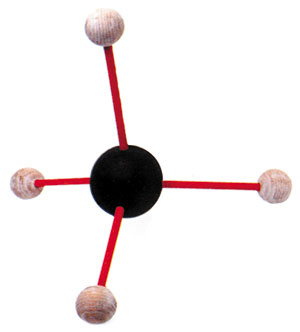
La structure du méthane : Quatre atomes d'hydrogène partagent un électron chacun avec un seul atome de carbone.
Nous avons dit que le carbone était particulièrement versatile pour former des liens avec d'autres atomes et que cette versatilité rend possible un énorme nombre de différents composés. La classe des composés formée exclusivement à base de carbone et d'hydrogène s'appelle les "hydrocarbures". Cette grande famille de composés inclut le gaz naturel, le pétrole liquide, le kérosène et les huiles de graissage. Les hydrocarbures comme l'éthylène et le propylène sont l'ossature sur laquelle l'industrie pétrochimique moderne a été érigée. Les hydrocarbures comme le benzène, le toluène et la térébenthine sont bien connues de tous ceux qui utilisent de la peinture. La naphtaline qui protège nos vêtements contre les mites est un autre hydrocarbure. En ajoutant du chlore à leur composition, quelques hydrocarbures peuvent devenir des anesthésiques ; en ajoutant du fluor, nous obtenons du Fréon, un gaz très répandu dans la réfrigération.
Il existe une autre famille importante de composés dans lesquels le carbone, l'hydrogène et l'oxygène forment des liens covalents entre eux. Au sein de cette famille, nous trouvons des alcools comme l'éthanol, le propane, les cétones, les aldéhydes et les acides gras parmi tant d'autres. Un autre groupe de composés formés à base de carbone, d'hydrogène et d'oxygène sont les sucres, y compris le glucose et le fructose. La cellulose, qui compose le squelette du bois et qui sert de matière première pour le papier, est un hydrate de carbone. Le vinaigre en est aussi un. Le sont aussi la cire d'abeille et l'acide formique. Chacune de la panoplie incroyablement riche de substances et de matériaux qui est produite sur Terre n'est rien d'autre qu'un différent agencement de carbone, d'hydrogène et d'oxygène reliés par des liens covalents.
Lorsque le carbone, l'hydrogène, l'oxygène et le nitrogène forment de tels liens, il en résulte une classe des molécules qui constitue la base même de la structure de la vie : Les acides aminés qui sont à l'origine des protéines. Les nucléotides qui composent l'ADN sont également des molécules formées à base de carbone, d'hydrogène, d'oxygène et d'azote.
En bref, les liens covalents composés du carbone sont essentiels à l'existence de la vie. Si l'hydrogène, le carbone, l'azote et l'oxygène n'étaient pas aussi "désireux" de se partager des électrons entre eux, la vie serait impossible. La "substance" qui permet au carbone de former ces liens est une propriété que les chimistes appellent la "métastabilité" : Elle détient la caractéristique d'avoir seulement une légère marge de stabilité. Le biochimiste J. B. S. Haldane décrit ainsi la métastabilité :
Une molécule métastable est une molécule qui peut libérer de l'énergie libre par une transformation, mais qui est assez stable pour durer longtemps à moins qu'elle soit activée par la chaleur, le rayonnement, ou l'union par le biais d'un catalyseur.90
Cette définition technique veut simplement dire que le carbone a une structure unique, grâce à laquelle il est tout à fait facile pour lui de créer des liens covalents sous des conditions normales.

L'huile de l'olive et le sucre brun : Tout ce que nous mangeons est composé de différents arrangements de l'hydrogène, de l'oxygène et du carbone.
Mais c'est précisément ici que la situation commence à devenir intéressante, car le carbone n'est métastable qu'à l'intérieur d'une marge de température très étroite. En d'autres termes, les composés de carbone deviennent très instables dès que la température dépasse les 100°C.
C'est un fait si banal de nos vies quotidiennes, que nous pouvons souvent l'observer. Quand par exemple nous faisons cuire de la viande, nous changeons la structure de ses composés de carbone. Cependant, à ce stade, il nous faut souligner un point : La viande cuite est devenue complètement "morte" ; en d'autres mots, sa structure chimique est totalement différente que quand elle faisait partie d'un organisme vivant. En effet la plupart des composés de carbone "se dénaturent" à des températures supérieures à 100°C : La majorité des vitamines se désintègrent à cette température ; les sucres subissent également des changements structurels et détruisent une partie de leur valeur nutritive ; et à environ 150°C, les composés de carbone commenceront à brûler. En d'autres termes, si les atomes de carbone rentrent en des liens covalents avec d'autres atomes et si les composés résultants veulent rester stables, la température ambiante ne doit pas dépasser 100°C. D'autre part, la limite inférieure se situe autour de 0°C : Si la température descend au-dessous, la biochimie organique devient impossible.
Dans le cas d'autres composés, ce n'est généralement pas le cas. La plupart des composés inorganiques ne sont pas métastables ; en d'autres mots, leur stabilité n'est pas vraiment affectée par des changements de température. Pour s'en rendre compte, faisons une expérience. Collez un morceau de viande sur l'extrémité d'un long et mince morceau de métal comme le fer, et chauffez-les les deux ensemble au-dessus du feu. Aussi longtemps que la température augmentera, la viande s'obscurcira et brûlera bien avant le métal. La même chose serait vraie si vous substituiez la pierre ou le verre au métal. Il vous faudrait augmenter la température de plusieurs centaines de degrés avant que les structures de tels matériaux commencent à changer.
Si vous faites bien attention, vous verrez que la température ambiante nécessaire aux composés de carbone à la fois pour former des liens covalents et pour rester stable est en fait l'intervalle de température qui règne sur notre planète. Comme nous l'avons déjà dit d'ailleurs, et ceci dans l'univers entier, la température ambiante peut varier de millions de degrés, des cœurs des étoiles jusqu'au zéro absolu (-273.15°C). Mais la Terre, ayant été créée pour que l'humanité puisse y vivre, possède l'intervalle de température ambiante essentielle à la formation des composés de carbone qui font parties des éléments constitutifs de la vie.
Mais ces étranges "coïncidences" ne s'arrêtent pas ici. Ce même intervalle de température est le seul dans lequel l'eau puisse rester liquide. Comme nous l'avons vu dans le chapitre précédent, l'eau liquide est l'une des conditions fondamentales à la vie et, afin de rester liquide, elle a besoin précisément des mêmes températures que les composés de carbone. Il n'existe aucune "loi" naturelle ou physique expliquant cet état de fait, ce qui prouve que les propriétés physiques de l'eau et du carbone et les conditions de la planète Terre ont été créées afin d'être en harmonie.
Les liens covalents ne sont pas les seuls types de liaison chimique qui gardent stables les composés de la vie. Il existe une autre catégorie de liens, connue sous le nom de "liens faibles".
Ces liens sont environ vingt fois plus faibles que les liens covalents, d'où leur nom ; mais ils ne sont pas moins cruciaux aux processus de la chimie organique. C'est grâce à cette liaison faible que les protéines qui constituent les éléments de base des espèces vivantes peuvent remettre à jour leur structures tridimensionnelles complexes et vitales pour la vie. Pour expliquer ceci, nous devons parler brièvement de la structure des protéines. Les protéines sont habituellement expliquées comme étant une "chaîne" d'acides aminés. Bien que cette métaphore soit relativement correcte, elle est cependant incomplète. Elle est incomplète car pour la plupart des personnes, une "chaîne des acides aminés" représente quelque chose comme un collier de perles alors que les acides aminés qui composent les protéines ont en fait une structure tridimensionnelle ressemblant davantage à un arbre aux branches feuillues.
Les liens covalents sont ce qui tiennent les atomes des acides aminés ensemble. Les liens covalents faibles sont ce qui remettent à jour la structure tridimensionnelle essentielle de ces acides. Aucune protéine ne pourrait exister sans ces liens faibles. Et il est évident que sans protéines la vie ne pourrait pas exister.
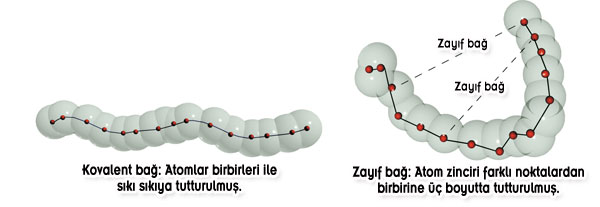
Ce qui est plus intéressant est que la température ambiante à laquelle les liens faibles peuvent exécuter leur fonction est identique à celle qui règne sur la Terre. Ceci est d'autant plus étrange car les natures physiques et chimiques des liens covalents versus les liens faibles sont entièrement différentes et sont indépendantes les unes des autres. En d'autres termes, il n'existe aucune raison intrinsèque à ce qu'elles exigent toutes deux la même température ambiante. Malgré cela, les deux types de liens peuvent être formés et rester stables seulement dans cet intervalle de température ambiante. Si ce n'était pas le cas -si les liens covalents exigeaient un intervalle de température très différent de celui des liens faibles- il serait alors impossible de construire les structures complexes tridimensionnelles des protéines.
Tout ce que nous avons vu au sujet des propriétés chimiques extraordinaires de l'atome de carbone prouve qu'il existe une grande harmonie entre cet élément, l'eau, qui constituent tous deux des éléments de base fondamentaux de la vie, et la terre, qui constitue l'abri pour cette vie. Dans Nature's Destiny, Michael Denton souligne ce phénomène :De tout l'énorme intervalle de températures du cosmos, il existe seulement une minuscule bande de température dans laquelle nous trouvons (1) l'eau liquide, (2) une incroyable plénitude de composés organiques métastables, et (3) les liens faibles pour stabiliser les formes en trois dimensions des molécules complexes.91
Parmi tous les corps céléstes qui ont été observés, cette "minuscule bande de température" existe seulement sur la Terre. D'ailleurs, c'est seulement sur la Terre que les deux éléments fondamentaux pour la vie -le carbone et l'eau- existent en de telles quantités.
Tout cela indique que l'atome de carbone et ses propriétés extraordinaires ont été particulièrement bien conçus pour la vie et que notre planète a été particulièrement bien créée pour avoir la fonction de maison pour abriter les formes de vie à base de carbone.
Nous avons vu pour quelle raison le carbone est l'élément constitutif le plus important de la matière organique et également comment il fut particulièrement bien conçu pour remplir sa fonction. L'existence même de toute forme de vie à base de carbone est cependant dépendante d'un deuxième impératif : L'énergie. L'énergie est une condition indispensable pour la vie.
Les plantes vertes obtiennent leur énergie du Soleil par le biais de la photosynthèse. Pour les autres espèces vivantes sur Terre –nous inclus- la seule source d'énergie provient de "l'oxydation", un processus qui est synonyme de "brûler". Le fait de "brûler" la nourriture provenant des plantes et des animaux crée l'énergie nécessaire aux organismes respirant de l'oxygène. Comme vous pouvez le deviner du terme "oxydation", cette action de brûler est une réaction chimique pendant laquelle les substances sont oxydées - soit qu'elles sont combinées avec de l'oxygène. C'est pourquoi l'oxygène, comme le carbone et l'hydrogène, est également d'une importance vitale. Une formule générale de l'oxydation (brûlement) ressemble à la formule ci-dessous :
Composé de carbone + oxygène > eau + dioxyde de carbone + énergie
Quand les composés de carbone et d'oxygène se combinent (sous des conditions naturelles bien sûr), une réaction produisant de l'eau et du dioxyde de carbone et qui libère une quantité d'énergie considérable a lieu. Cette réaction est plus fréquente au sein des hydrocarbures (composés d'hydrogène et de carbone). Le glucose (un sucre et également un hydrocarbure) est l'élément qui est constamment oxydé afin de maintenir un certain niveau d'énergie dans votre corps.
Les éléments d'hydrogène et de carbone qui composent les hydrocarbures sont les plus appropriés pour que l'oxydation ait lieu. Parmi tous les autres atomes, l'hydrogène se combine le plus aisément avec l'oxygène et libère la plus d'énergie dans le processus. Il n'existe du reste aucun meilleur carburant que l'hydrogène pour libérer l'énergie contenue dans l'oxygène. Le carbone est le troisième meilleur carburant, juste après l'hydrogène et le bore. Dans The Fitness of the Environment, Lauwrence Henderson présente ses observations sur cette perfection physique extraordinaire :"Les changements chimiques qui pour tant d'autres raisons semblent être les mieux adaptés pour devenir les processus de la physiologie, sont ceux qui peuvent détourner de la meilleure façon la plus grande quantité d'énergie dans le cours de la vie"92
Comme nous l'avons déjà vu, la réaction fondamentale qui libère l'énergie nécessaire pour la survie des organismes respirant l'oxygène est l'oxydation des hydrocarbures. Mais, ce fait simple soulève une question préoccupante : Si nos corps sont composés essentiellement d'hydrocarbures, pourquoi ne sont-ils pas également oxydés ? Autrement dit, pourquoi ne brûlons-nous pas comme une simple allumette ?
Nos corps sont constamment en contact avec l'oxygène contenu dans l'air mais ils ne s'oxydent pas ; en d'autres mots, ils ne s'allument pas. Mais pourquoi donc ?
La raison de ce paradoxe est que sous des conditions de température et de pression normales, la forme moléculaire (O2) de l'oxygène comporte un degré substantiel d'inertie ou de "noblesse". (Dans le sens utilisé par les chimistes, la "noblesse" est l'hésitation (ou l'incapacité) d'une substance à entrer en réaction chimique avec d'autres substances.) Ceci cependant soulève d'autres questions : Si l'oxygène moléculaire est bel et bien "noble", comment se fait-il que cette même molécule soit créée de façon à pouvoir entrer dans des réactions chimiques à l'intérieur de nos corps ?La réponse à cette question, qui rendit perplexes les chimistes au milieu du 19ème siècle, ne fut pas trouvée avant la deuxième moitié du 20ème siècle. Après la deuxième guerre mondiale, les chercheurs de biochimie ont découvert l'existence d'enzymes dans le corps humain dont l'unique fonction est de forcer l'O2 contenu dans l'atmosphère à entrer en réaction chimique. Suite à une série d'étapes extrêmement complexes, ces enzymes utilisent les atomes de fer et de cuivre contenus dans nos corps comme catalyseurs. Un catalyseur est une substance qui lance une réaction chimique et qui lui permet de procéder sous des conditions (comme à température plus basse etc.) qui seraient autrement possibles.93
En d'autres termes, nous avons ici une situation très intéressante : L'oxygène est l'élément qui permet l'oxydation et la combustion, et est donc le potentiel "brûleur" de notre corps. Pour empêcher ceci, la forme moléculaire (O2) de l'oxygène qui existe dans l'atmosphère a été rendue "noble" chimiquement. Soit qu'elle n'entre pas facilement en réactions. Mais, d'un autre côté, nos corps dépendent pour leur besoin en énergie de la propriété d'oxydation de l'oxygène. C'est donc pour cette raison que nos cellules ont été équipées d'un système d'enzymes extrêmement complexe qui rend ce gaz noble très actif.
A ce stade, nous devrions également préciser que ce système d'enzymes est le parfait exemple de cette merveilleuse conception que la théorie de l'évolution prétend être le résultat de pures coïncidences.94
Il existe encore une autre précaution qui a été prise pour empêcher que notre corps s'enflamme soudainement : Celle-ci est ce que le chimiste britannique Nevil Sidgwick appelle "l'inertie caractéristique du carbone".95Cela signifie simplement que l'atome de carbone n'entre pas facilement en réaction avec de l'oxygène sous des conditions de pression et de température normales. Cette caractéristique, exprimée en langage chimique, peut nous paraître des plus compliquées alors que ce phénomène est en fait souvent observé dans notre vie quotidienne. La difficulté d'allumer du bois ou du charbon pendant un jour d'hiver est en réalité cette "noblesse caractéristique" du carbone. Afin que le feu puisse brûler, il vous faut tenir compte de plusieurs préliminaires (allumeur, démarreur, etc.) pour que la température du carburant augmente à un degré très élevé. Mais une fois que le carburant commence à brûler, le carbone qu'il contient entre rapidement en réaction avec l'oxygène et une grande quantité d'énergie est ainsi libérée. C'est pourquoi il est si difficile d'obtenir du feu à l'aide d'une autre source de chaleur. Mais, après la combustion, une quantité telle de chaleur se dégage qu'elle peut facilement se propager à d'autres composés de carbone qui se trouvent aux alentours.
En examinant cette matière plus soigneusement, nous remarquerons que le feu même est conçu d'une manière très intéressante. Les propriétés chimiques de l'oxygène et du carbone ont été arrangées de telle sorte à ce que ces deux éléments n'entrent ensemble en réaction (combustion) que lorsqu'une grande quantité de chaleur est déjà présente. Ceci est bien car si cela n'était pas le cas, la vie sur cette planète serait très désagréable, voire complètement impossible. Si l'oxygène et le carbone étaient juste un peu plus disposés à réagir entre eux, la combustion spontanée des personnes, des arbres et des animaux deviendrait un événement banal à chaque fois que la température augmenterait un peu. Quelqu'un qui marcherait dans un désert, par exemple, pourrait soudainement prendre feu à midi, quand la température est à son degré le plus élevé ; de plus, les plantes et les animaux seraient exposés au même risque. Dans un tel monde, il serait difficile de parler de vie.
D'autre part, si le carbone et l'oxygène étaient légèrement plus nobles (c'est-à-dire, légèrement moins réactifs) qu'ils ne le sont, il serait beaucoup plus difficile voire impossible d'allumer un feu dans ce monde. Et sans feu, nous ne pourrions pas nous réchauffer. Il est de plus tout à fait probable que sans chaleur, il n'y aurait jamais eu de progrès technologique sur notre planète, car ces progrès dépendent largement de notre capacité à pouvoir travailler des matériaux tels que le métal. Et sans la chaleur du feu, le purifier et le travailler est presque totalement impossible. Tout ceci démontre que les propriétés chimiques du carbone et de l'oxygène ont été arrangées afin d'être le mieux adaptées aux besoins de l'humanité. A ce sujet, Michael Denton déclara :
Cette étrange non-réactivité du carbone et des atomes d'oxygène aux températures ambiantes, combinée avec les énergies inhérentes énormes qui se dégagent suite à leur combinaison, a une grande importance pour la vie terrestre. C'est cette étrange combinaison de carbone et d'oxygène qui assure aux êtres vivants complexes de l'énergie d'une manière contrôlée et régulière et aussi, qui rend l'utilisation du feu et des énergies massives de la combustion possible pour l'humanité.96
Autrement dit, le carbone et l'oxygène sont tous les deux créés de façon à être le mieux adapté à la vie humaine. Les propriétés de ces deux éléments nous permettent d'allumer un feu et de nous servir du feu de la manière la plus commode possible. En outre, le monde comporte de nombreuses sources de carbone (telles que le bois des arbres) qui sont adaptées pour la combustion. Tout cela est une indication qui montre que le feu et les matériaux qui lui sont nécessaires ont été créés de la façon la plus adaptée à la vie humaine. Dans le Coran, nous pouvons lire :
C'est Lui qui, de l'arbre vert, a fait pour vous du feu, duquel vous allumez (vos foyers). (Sourate Ya-sîn : 80)
L'utilisation de l'oxygène par le corps est fortement dépendante de sa capacité à se dissoudre dans l'eau. L'oxygène qui entre dans nos poumons quand nous respirons se dissout immédiatement dans le sang. La protéine appelée hémoglobine capture ces molécules d'oxygène et les transporte aux autres cellules du corps où, grâce au système d'enzymes spécial décrit ci-dessus, l'oxygène est employé pour oxyder les composés de carbone appelés ATP afin qu'ils libèrent leur énergie.
Tous les organismes vivants complexes dérivent leur énergie de cette façon. Cependant, la réalisation de ce système dépend en particulier de la solubilité de l'oxygène. Si l'oxygène n'était pas suffisamment soluble, celui qui entrerait au sein de la circulation sanguine ne le serait pas suffisant et les cellules ne pourraient pas produire l'énergie dont elles ont besoin ; si, d'autre part, l'oxygène était trop soluble, il y aurait un excès d'oxygène dans le sang qui aurait pour résultat une situation connue sous le nom de toxicité de l'oxygène.
La différence de solubilité dans l'eau des différents gaz varie d'un facteur d'un million. En d'autres termes, le gaz le plus soluble est un million de fois plus soluble dans l'eau que l'est le gaz le moins soluble. De plus, aucun gaz ne comporte la même solubilité. Par exemple, le dioxyde de carbone est environ vingt fois plus soluble dans l'eau que l'est l'oxygène. Parmi tous les différents degrés de solubilités potentielles, l'oxygène détient celui qui est le plus propice pour la vie humaine.
Que se produirait-il si la capacité de solubilité dans l'eau de l'oxygène était différente : Un peu plus ou un peu moins ? Jetons un coup d'œil à la première situation. Si l'oxygène était moins soluble dans l'eau (ainsi que dans le sang), moins d'oxygène entrerait dans la circulation sanguine et les cellules de corps seraient en manque d'oxygène. Ceci rendrait la vie beaucoup plus difficile pour des organismes métaboliquement actifs tels que les êtres humains. Même si vous essayez de respirer le plus possible, vous seriez constamment confrontés au danger de suffocation créé par le manque d'oxygène atteignant vos cellules. Si, par contre, le degré de solubilité de l'oxygène dans l'eau était plus élevé, vous seriez constamment confrontés à la menace de toxicité de l'oxygène, mentionnée brièvement ci-dessus. L'oxygène est en fait une substance plutôt dangereuse : Si un organisme en ingurgite trop, cela peut être mortel. Une partie de l'oxygène contenu dans le sang entre en réaction chimique avec l'eau contenue dans le sang. Si la quantité d'oxygène dissous est trop élevée, il en résulte une production de sous-produits fortement réactifs et préjudiciables. L'une des fonctions du système complexe des enzymes du sang est d'empêcher ceci de se produire. Mais, si la quantité d'oxygène dissous devient trop importante, les enzymes ne peuvent pas faire leur travail. Dans un tel cas, chaque respiration supplémentaire nous empoisonnerait un peu plus et nous mènerait rapidement à la mort. Le chimiste Irwin Fridovich présente ses observations sur cette question :
Tous les organismes qui respirent sont pris dans un piège cruel. L'oxygène qui leur permet de vivre est toxique pour eux et ils ne peuvent survivre que grâce à certains mécanismes de défense très élaborés.97
Ce qui nous empêche d'être empoisonné par un surplus d'oxygène ou de suffoquer dû à une insuffisance est la solubilité de l'oxygène et le système enzymatique complexe du corps. Tous deux ont été soigneusement conçus et créés pour avoir la fonction qu'ils détiennent actuellement. Plus clairement, Allah a créé non seulement l'air que nous respirons mais également les systèmes qui permettent d'utiliser cet air en harmonie parfaite.
Le carbone et l'oxygène ne sont évidemment pas les seuls éléments qui ont été délibérément conçus pour rendre la vie possible. Les éléments comme l'hydrogène et l'azote, qui composent une grande partie des corps des espèces vivantes, possèdent également les attributs rendant la vie possible. En fait, tous les éléments qui se trouvent dans le tableau périodique des éléments sont dotés, d'une certaine manière, de fonctions particulières pour entretenir la vie.
Le tableau périodique des éléments comporte quatre-vingt-douze éléments qui s'étendent de l'hydrogène (le plus léger) à l'uranium (le plus lourd). (Il y a naturellement d'autres éléments au-delà de l'uranium, mais ceux-ci n'ont pas été produits d'une manière naturelle mais artificiellement dans des laboratoires. Aucun d'entre eux n'est stable.) Parmi ces quatre-vingt-douze éléments, vingt-cinq sont essentiels pour la vie et, parmi ceux-ci, les onze premiers, soit l'hydrogène, le carbone, l'oxygène, l'azote, le sodium, le magnésium, le phosphore, le soufre, le chlore, le potassium et le calcium, composent à peu près 99% du poids corporel de presque toutes les espèces vivantes. Les quatorze éléments restants, soit le vanadium, le chrome, le manganèse, le fer, le cobalt, le nickel, le cuivre, le zinc, le molybdène, le bore, le silicium, le sélénium, le fluor et l'iode, ne sont présents dans la matière organique qu'en très petites quantités mais ont également des fonctions extrêmement importantes. Trois autres éléments, soit l'arsenic, l'étain et le tungstène, se trouvent également dans les espèces vivantes mais leurs fonctions ne sont pas complètement comprises. Finalement, nous savons que trois autres éléments encore, soit le brome, le strontium et le baryum, sont présents dans la plupart des organismes mais nous ignorons totalement leurs fonctions.98
Parmi ces quatre-vingt-douze éléments, vingt-cinq sont essentiels pour la vie et, parmi ceux-ci, les onze premiers, soit l'hydrogène, le carbone, l'oxygène, l'azote, le sodium, le magnésium, le phosphore, le soufre, le chlore, le potassium et le calcium, composent à peu près 99% du poids corporel de presque toutes les espèces vivantes. Les quatorze éléments restants, soit le vanadium, le chrome, le manganèse, le fer, le cobalt, le nickel, le cuivre, le zinc, le molybdène, le bore, le silicium, le sélénium, le fluor et l'iode, ne sont présents dans la matière organique qu'en très petites quantités mais ont également des fonctions extrêmement importantes. Trois autres éléments, soit l'arsenic, l'étain et le tungstène, se trouvent également dans les espèces vivantes mais leurs fonctions ne sont pas complètement comprises. Finalement, nous savons que trois autres éléments encore, soit le brome, le strontium et le baryum, sont présents dans la plupart des organismes mais nous ignorons totalement leurs fonctions.98
Ce large éventail contient les atomes de différentes séries du tableau périodique, dont les éléments sont groupés selon les attributs de leurs atomes. Ceci indique que tous les groupes d'éléments du tableau périodique sont, d'une manière ou d'une autre, nécessaires pour la vie. Dans The Biological Chemistry of the Elements, J. J. R Frausto da Silva et R. J. P Williams s'expriment ainsi :
Les éléments biologiques semblent avoir été choisis de pratiquement tous les groupes et sous-groupes du tableau périodique... et ceci signifie que pratiquement toutes les sortes de propriétés chimiques sont associées aux processus de la vie dans les limites imposées par les contraintes environnementales.99
Même les éléments lourds et radioactifs qui se situent à la fin du tableau périodique ont été mis au service de la vie humaine. Dans Nature's Destiny, Michael Denton décrit en détail le rôle essentiel que jouent ces éléments radioactifs, tels que l'uranium, dans la formation de la structure géologique de la Terre. La radioactivité naturelle est étroitement associée au fait que le noyau de la Terre puisse retenir sa chaleur. Cette chaleur est ce qui permet au noyau, composé de fer et de nickel, de rester liquide. Ce noyau liquide est la source du champ magnétique de la Terre qui aide, comme nous l'avons vu ailleurs, à protéger la planète des particules et des rayonnements dangereux de l'espace tout en exécutant également d'autres fonctions. Même les gaz inertes et les éléments tels que les métaux qui sont rares sur Terre, qui paraissent inutiles pour la vie, sont des étapes nécessaires pour s'assurer que la variété des éléments naturels puisse s'étendre jusqu'à l'uranium.100
En bref, il est certain que tous les éléments dont nous connaissons l'existence ont une fonction spécifique pour la vie humaine. Aucun d'entre eux n'est superflu ou sans but. Cette situation prouve à nouveau que l'univers a été créé pour l'humanité par Allah.
Chaque propriété physique et chimique de l'univers que nous avons examiné s'avère être ce dont la Terre a besoin pour exister. Mais, dans ce livre, nous avons seulement "gratté" la surface de cette preuve accablante. Cependant, même si vous fouillez plus en détail ou si vous élargissez votre recherche, cette observation générale demeurera toujours vraie : dans chaque détail de l'univers, il y a un but qui sert la vie humaine et ces détails sont parfaitement conçus, équilibrés et harmonisés pour réaliser ce but.
Ceci est assurément la preuve indéniable de l'existence d'un créateur supérieur qui a permis à l'univers de parvenir à cette fin. Dans n'importe quelle propriété de la matière que nous puissions examiner, nous trouvons la connaissance, la sagesse, et la puissance infinies d'Allah, Celui qui l'a créée du néant. Chaque chose est soumise à Sa volonté et c'est pourquoi toute chose est en harmonie parfaite.
C'est la conclusion que la science du 20ème siècle a finalement atteinte. Pourtant, ce n'est que la reconnaissance d'un fait qui a été énoncé à l'humanité dans le Coran plus de quatorze siècles auparavant : Allah a créé chaque détail de l'univers pour indiquer la perfection de Sa propre création :
Exalté soit (Allah) Celui dans la Main de qui est la royauté, et Il est Omnipotent. Celui qui a créé la mort et la vie afin de vous éprouver (et de savoir) qui de vous est le meilleur en œuvre, et c'est Lui le tout Puissant, le Pardonneur. Celui qui a créé sept cieux superposés sans que tu voies de disproportion en la création du Tout Miséricordieux. Ramène (sur elle) le regard. Y vois-tu une brèche quelconque ? Puis, retourne ton regard par deux fois : le regard te reviendra humilié et frustré. (Sourate Al-Moulk : 1-4)
84. "Science Finds God", Newsweek, 27 Temmuz 1998 ![]()
85. Robert E. D. Clark, The Universe: Plan or Accident?, London, Paternoster Press, 1961, s. 98![]()
86. Fred Hoyle, Religion and the Scientists, London: SCM, 1959; M. A. Corey, The Natural History of Creation, Maryland: University Press of America, 1995, s. 341![]()
87. David Burnie, Life, Eyewitess Science, London: Dorling Kindersley, 1996, s. 8![]()
88. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, s. 490![]()
89. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1., s. 490![]()
90. J. B. S. Haldane, "The Origin of Life", New Biology, 1954, vol. 16, s. 12![]()
91. Michael Denton, Nature's Destiny, s. 115-116![]()
92. Lawrence Henderson, The Fitness of the Environment, Boston: Beacon Press, 1958, s. 247-48![]()
93. L. L. Ingraham, "Enzymic Activation of Oxygen", Comprehensive Biochemistry, (ed. M. Florkin, E. H. Stotz), Amsterdam: Elsevier, vol. 14, s. 424![]()
94. Oksijen solunumunu sağlayan kompleks enzim sisteminin nasıl ortaya çıktığı sorusu, evrim teorisinin açıklayamadığı sayısız sorulardan biridir. Bu enzim sisteminin özelliği, ancak eksiksiz çalışması halinde işe yaramasıdır, dolayısıyla daha basite indirgenemez. Bu nedenle de evrimin iddia ettiği gibi basitten karmaşığa doğru bir gelişim izlediği öne sürülemez. Türkiye'nin en önde gelen evrim savunucularının başında gelen Hacettepe Üniversitesi biyoloğu Prof. Ali Demirsoy, bu konuda şu itirafı yapmaktadır:
"Yalnız, burada henüz çözülemeyen bir sorun vardır. Mitokondriler bu (oksijenli) parçalamaları gerçekleştirirken belirli sayıda enzim kullanırlar. Bu enzimlerin bir tanesinin eksikliği tüm sistemin durmasına neden olur. Ayrıca oksijenli enerji kazanımı, kademe kademe gelişecek bir sistem olarak da görünmemektedir. Tümü, ancak bir işlev sistemi oluşturur. Bu nedenle buraya kadar ilke olarak savunduğumuz kademe kademe gelişme yerine, ister istemez, çok az bir olasılık da olsa, mitokondrilerin oksijenli tepkimelerini yürütecek tüm enzimlerin (Krebs enzimleri) bir defada, bir rastlantı sonucu bir hücreye girdiğini ya da bir defada o hücre içinde oluştuğunu kabul etmek zorundayız. Çünkü oksijeni tam olarak kullanamayan, yani ara kademede kalan tüm sistemler, oksijenle temas edince yok olacaktı. (Ali Demirsoy, Yaşamın Temel Kuralları: Genel Biyoloji, Genel Zooloji, cilt 1, kısım 1, Ankara, 1998, s. 578)
Ali Demirsoy'un "hepsinin bir anda tesadüfen oluştuğunu kabul etmek zorundayız"dediği enzimlerin (özel proteinlerin) tek birinin tesadüfen oluşma şansı bile 10950'de 1'lik ihtimallerde iken, yani imkansızken, bu tip çok sayıda enzimin tesadüfen oluştuğunu öne sürmek, elbette ki akıl dışıdır. ![]()
95. Nevil V. Sidgwick, The Chemical Elements and Their Compounds, vol 1. Oxford: Oxford University Press, 1950, s. 490![]()
96. Michael Denton, Nature's Destiny, s. 122-123![]()
97. Irwin Fridovich, "Oxygen Radicals, Hydrogen Peroxide, and Oxygen Toxicity", Free Radicals in Biology, (ed. W. A. Pryor), New York: Academic Press, 1976, s. 239-240![]()
98. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, Oxford: Oxford University Press, s. 3-4![]()
99. J. J. R. Fraústo da Silva, R. J. P. Williams, The Biological Chemistry of the Elements, s. 5![]()