Жансыз Атомдорду Белокторго Айланткан Кемчиликсиз Долбоор
Белгилүү болгондой, бүт жандыктар клеткалардан турат. Мисалы, адамдын денесин түзгөн болжол менен 100 триллион клетка бар. Ар клетка болсо тынымсыз жандык өмүр бою муктаж боло турган нерселерди өндүрөт. Жандыктардын клеткаларын жогорку технологиялар менен жабдылган заводдор деп кабыл алсак, анда бул китептин темасы болгон белоктор – ал заводдун жабдыктары, дубалдары, төбөсү, тепкичтери, эшиктери жана ал тургай бурамалары. Кыскасы, белоктор клеткалардын курулуш материалдарын да, өтө татаал жабдыктарын (машина) да түзүшөт. Ар кандай көптөгөн кызматтарды аркалаган белоктор ушул себептен жашоонун курулуш материалдары деп кабыл алынат.

|
Мисалы, чач, тырмак жана түктөрдөгү катуу түзүлүштү пайда кылган кератин аттуу зат – бир белок. Кээ бир белоктор булчуңдарды сөөккө туташтырган тарамыштардагы бекем нейлон сыяктуу бир затты түзүшөт. Теринин тырышсыз ийкемдүүлүгүн жана сөөктөрдүн чыдамкайлыгын камсыз кылган болсо коллаген аттуу башка бир белок. Артерияларды орогон каучукка окшош ийкемдүү затты түзгөн да кайра эле башка бир белок. Тордомо челге нур тийгенде көрүү таасирин баштаган болсо родопсин аттуу белок. Бул убакта башка белоктор болсо көздүн линзасын түзгөн тунук затты түзүшөт. Клеткалардын ичине молекулалардын кирип-чыгышында да кайра эле атайын ташуучу белоктор кызмат кылышат. Бүт жандыктардын маалыматын алып жүрчү ДНК молекуласы белокторсуз копиялана да албайт, маалымат да өндүрө албайт жана клетка бөлүнүшүн да камсыздай албайт. Б.а. белоктор жандыктардагы эң кичинекей жашоо элементи болгон клеткалардын түзүлүштөрүндө дагы, сансыз функцияларында дагы көптөгөн ар түрдүү кызматтарды аркалашат. Башка кээ бир белоктор болсо клеткадагы химиялык реакциялардын ылдамдыгын миллиарддаган эсе ылдамдатуу үчүн катализатор кызматын аткарышат. Командалык иш алып баруу менен клетканын бүт химиялык бөлүктөрүн курушат. Куруу өзгөчөлүгү менен бирге майдалоо өзгөчөлүгүнө да ээ. Бул өзгөчөлүктөрүн колдонушуп клеткалардагы чоң молекулаларды клетка колдоно ала турган майда кошулмаларга бөлүшөт. Клетканы энергия менен камсыздоо үчүн керек болгон реакциялардын жүрүшүнө шарт түзүшөт. Булчуңдардагы жыйрылуу кыймылы үчүн керектүү элементтерди түзгөндөр да – кайра эле булчуң клеткаларындагы атайын белоктор.
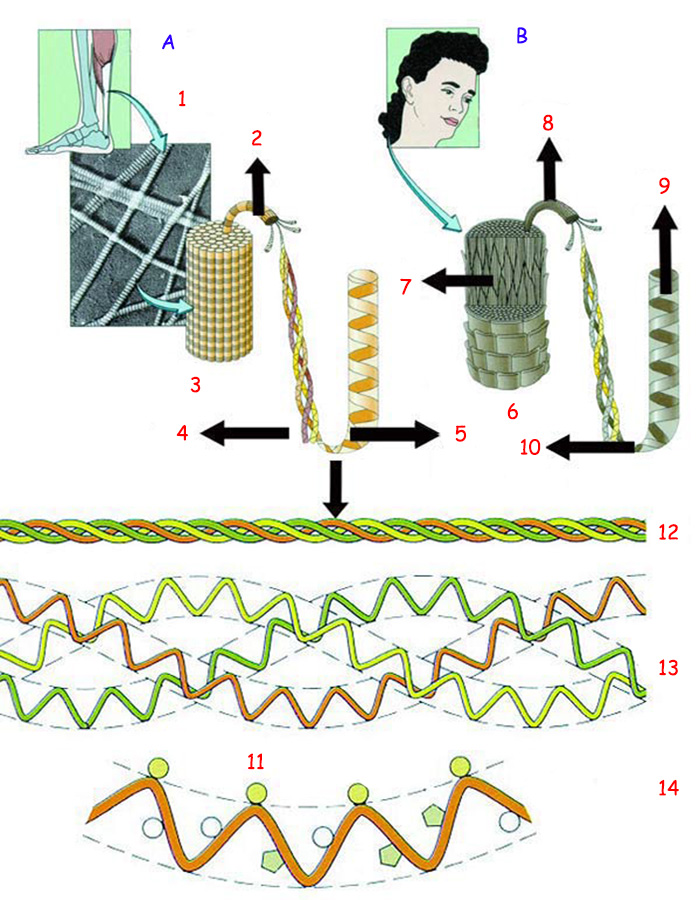
| |
|
(A) KOLAJEN, GÜÇLÜ LİFLİ BİR PROTEİN |
(B) KERATİN, SAÇIN LİFLİ PROTEİNİ |
|
1. Mikrofibril |
7. Keratin mikrofibrili |
|
Yukarıda kemiklerin dayanıklılığını sağlayan kolajen proteininin ve saçlarda bulunan keratin proteininin yapısı görülmektedir. Altta ise kolajen lifinin açılımı yer almaktadır. | |
Бул жерде саналгандар миңдеген белок түрүнүн бир канчасына гана тиешелүү өзгөчөлүктөр. Сиз бул саптарды окуп жатканыңызда дагы денеңиздеги ар бир белок түрү өмүрүңүздү толук кандуу улантышыңыз үчүн тынымсыз өз кызматтарын аткарып жатышат. Китепте жазылгандарды окуй алышыңыздан тамагыңызды жей алышыңызга, денеңиздин өсүшүнөн ооруларга каршы тирешүү мүмкүнчүлүгүңүзгө чейин көптөгөн муктаждыктарыңыз клеткаларыңызда тынымсыз иштеп жаткан белоктор урматында канааттандырылууда. Бир эле адам денесинде эмес, өсүмдүктөрдөн бүт жаныбар түрлөрүнө, эң жөнөкөй бактерияларга чейин бүт жандыктардын жашоо иш-аракеттеринин баары белокторго таянат.
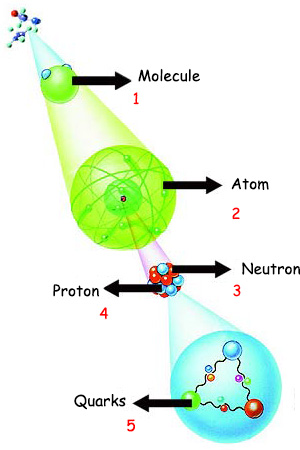
|
1. Molekül Belli atomların belli sıralarda ve belli bağlarla birbirlerine bağlanmaları, onları proteinler gibi özel işlevleri olan mucize moleküllere dönüştürür. Yanda bir molekülü oluşturan atomların iç yapıları görülmektedir. |
Китепте карала тургандай, белгилүү сандагы атомдун биригишинен пайда болгон бул кереметтүү молекулалар бир-бири менен кемчиликсиз гармонияда, өтө чоң бир акыл жана аң-сезимдүүлүктү көрсөтүп, кереметтүү жоопкерчиликтерди орундатышат. Алдыда айтыла турган ар темада акылы жана абийири бар ар бир адам өзүнө бир суроону сурашы керек: жансыз атомдордун биригишинен пайда болгон аң-сезими, илими жана жөндөмү жок болушу күтүлгөн белок молекулалары кандайча болуп кереметтүү бир акыл, уюшуу жөндөмүн жана жоопкерчиликтүүлүк көрсөтүшүп, бүт бул иш-аракеттерди аткара алышууда? Чын ыкластан ойлонгон ар бир адам мунун жообунун чексиз кудуреттүү жана илимдүү Аллахтын кемчиликсиз жаратышы экенин көрүп, эң кичинесинен эң чоңуна чейин ааламдагы бүт нерселердин Аллахтын башкаруусу жана буйругу астында экенин түшүнөт. Аллахтын бүт нерселердин өкүмдары экени бир аятта мындайча кабар берилет:
Мен чындыгында, менин да Раббим, силердин да Раббиңер болгон Аллахка тобокел кылдым. Ал маңдайынан кармап-көзөмөлдөбөгөн эч бир жандык жок. Сөзсүз менин Раббим туптуура бир жол үстүндө (туптуура жолдогуну коргоодо).
(Худ Сүрөсү, 56)
Аң-Сезими Жок Атомдор Курган Жөндөмдүү Белоктор
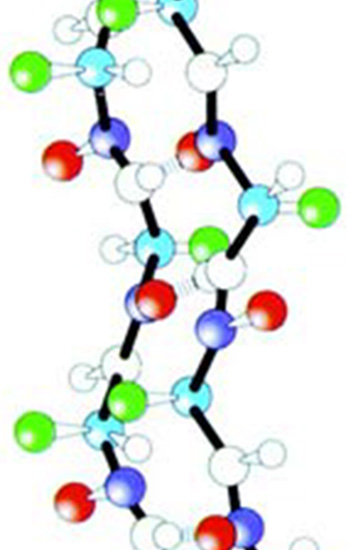
Сүрөттө цитохром-с аттуу бир белоктун атом түзүлүшү чагылдырылган. Миллиметрдин миллиондон бешиндей кичинекей болгон бул белок болжол менен 1000 атомдун биригишинен түзүлөт. Сүрөттөн да көрүнүп тургандай, ал атомдордун араларындагы уюшкандык жана бир-бири менен биригүү формасы өтө комплекстүү.
Эми бул сүрөттү карап ойлонолу. Эволюционисттер бул 1000 атом кокустан чогулуп, ушундай формада бир-бири менен биригишкен дешет. Жана бул туш келди биригүүнүн натыйжасында “кокустан” жандыктын жашоосу үчүн өтө маанилүү кызматтарга ээ болгон цитохром-с белогу пайда болгон дешет. Болгондо да бул 1000 атомдун арасында темир, көмүртек, азот сыяктуу көптөгөн ар түрдүү атомдор бар. Б.а. цитохром-сны пайда кылуу үчүн керектүү болгон ар түрдүү атомдор белгилүү санда, белгилүү убакта, белгилүү жерде болушу керек, анан керектүү жерлерден бир-бири менен өз-өзүнчө, сүрөттөн көрүнүп тургандай, эң ылайыктуу химиялык байланыштар менен байланышы керек. Эволюционисттердин мындай такыр логикасыз жана акылга сыйбас пикирлери боюнча баары кокустан болушу керек, бирок жашоо үчүн өтө маанилүү болгон бир белок, ошого карабастан, пайда болгон болушу керек.
Болгондо да, эволюционисттер цитохром-с белогунун пайда болушу үчүн эле эмес, жашоо үчүн керек болгон миңдеген белоктун пайда болушу үчүн да ушул эле кокустук жомогун айтышат. Көмүртек, азот, темир, фосфор сыяктуу аң-сезимсиз, жансыз, эч нерседен кабарсыз атомдор ар кандай санда жана ар кандай тартипте биригип жашоо үчүн керектүү болгон бүт белокторду пайда кылган деп айтуу акыл менен логикага эч сыйбайт.
Миллиметрдин миллиондон бешиндей жерди ээлеген бул кичинекей түзүлүштөрдүн жандыктардын денесинде аткарган кызматтарын көргөндө болсо, аң-сезимсиз атомдордун мынчалык маанилүү түзүлүштөрдү кокустан курган деп айтуунун канчалык чоң логикасыздык жана акылсыздык экени түшүнүктүү болот.
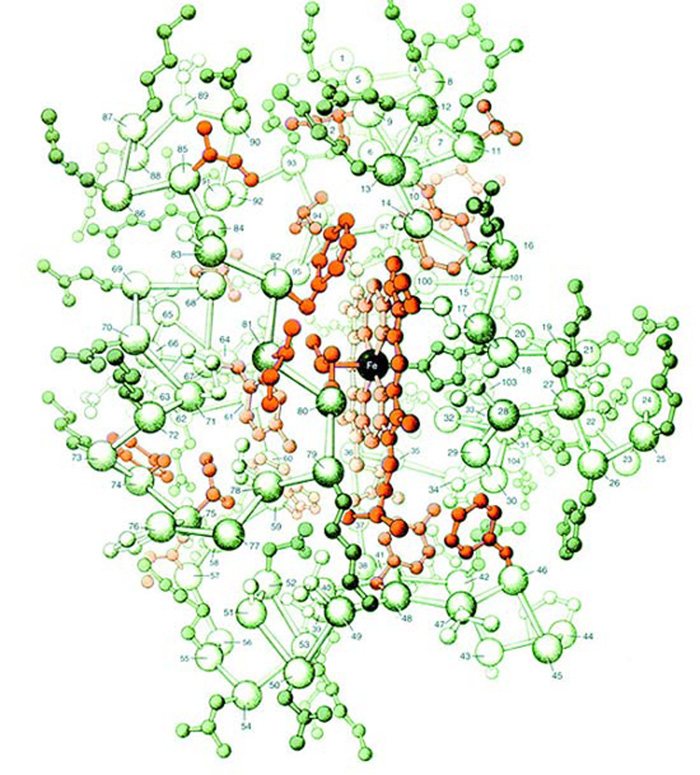
|
|
sitokrom-c proteininin üç boyutlu yapısı |
Мисалы, кээ бир белоктор чачтарды, тырмактарды жана жаныбарлардын жүндөрүн түзгөн тефлонго окшош затты түзөт. Кээ бирлери булчуңдарды сөөктөргө карматкан тарамыштарды түзөт. Мындан тышкары, клеткага келген кабарларды алып келгендер да, кабарларды алган жана анализдегендер да белоктор. Клетканын ичине кирип-чыгууларды контрольдогон эшиктер жана насос системалары да белоктор. Химиялык реакцияларды ылдамдаткандар да белоктор. Гемоглобин аттуу белок кандагы кычкылтекти кыртыштарга ташыйт. Трансферрин аттуу белок болсо кандагы темирди ташыйт. Иммуноглобулиндер бактерия менен вирустарга каршы денени коргогон белоктор. Фибриноген менен тромбин болсо кандын уюп катышын камсыз кылат. Инсулин денедеги шекер метаболизмин жөнгө салуучу бир белок түрү.
Кээ бир жандыктарда адам денесинде жок, бирок ал жандыктын өмүрү үчүн өтө чоң мааниге ээ башка белоктор да болот. Мисалы, кээ бир балыктардын канындагы антифриз белогу ал балыктардын канын тоңуп калуудан коргойт. Чымын-чиркей канаттарынын кыймылын камсыз кылган резилин белогу дээрлик эч кемчиликсиз бир ийкемдүүлүк өзгөчөлүгүнө ээ. Болгону 20 аминокислотанын, б.а. бир канча жүз атомдун биригишинен пайда болгон бул молекулалардын мынчалык ар түрдүү өзгөчөлүктөргө ээ болушу өзүнчө бир керемет. Атомдордун чогулуп, мынчалык өтө маанилүү кызматты аткарган, акыл көрсөткөн, уюша алган, эң керектүү жерде эң керектүү чечимди алып, аны ишке ашыра алган түзүлүштөрдү кокустан пайда кылган болушу эч мүмкүн эмес. Дээрлик окшош атомдордон турган белоктордун кызмат жана функцияларынын мынчалык ар түрдүү болушу өзүнчө бир ойлонуу керек болгон жагдай. Белоктор көбүнчө окшош атомдордон турат. Бирок ал атомдордун ар кандай санда жана ар түрдүү тизилиши ал белок молекуласына ар башка кызмат менен жөндөмдөр берет. Буларды эч кокустуктар менен түшүндүрүүгө болбойт. Негизи эволюционисттер да муну мойнуна алышат. Мисалы, Түркиянын алдыңкы эволюционисттеринен профессор Али Демирсой (Prof. Ali Demirsoy) цитохром-с белогунун пайда болушу жөнүндө мындай дейт:
“Бир цитохром-Снын тизилишин пайда кылуу үчүн ыктымалдык нөл дей турганчалык аз... Же пайда болушунда биз түшүндүрө албай турган табияттан жогорку күчтөр кызмат аткарган. Бул акыркыны кабыл алуу илимий максатка туура келбейт. Демек биринчи гипотезаны карап чыгыш керек.”3
Демирсой китебинин башка бир бөлүмүндө болсо цитохром-снин кокустан пайда болуу ыктымалдыгы жөнүндө
“бир маймылдын жазуучу машинкада эч ката кетирбестен адамзаттын тарыхын жазуу ыктымалдыгындай аз” дейт.4

|

|
|
Tesadüfler hiçbir zaman kompleks bir tasarım meydana getiremezler. Proteinler gibi üstün bir tasarıma sahip moleküllerin tesadüfen oluştuğunu söylemek, taş yığınlarının rüzgarlar sayesinde bir heykele veya kayalara vuran dalgalar sayesinde tesadüfen mimari bir harikaya dönüştüğünü iddia etmekten çok daha mantıksız ve akıl dışıdır. |
Бир маймыл жазуучу машинкада эч ката кетирбестен адамзат тарыхын жаза албайт, демек цитохром-с белогу да эч качан кокустан пайда боло албайт. Бирок Демирсойдун мурдакы сөзүндө айтылгандай, эволюционисттер үчүн табияттан жогорку күчтөрдүн бар экенин кабыл алуу “илимий максатка туура келбейт”. Б.а. эволюционист илимпоздордун “илимий максаты” (!) Аллахтын бар экенин жокко чыгаруу жана материализмди жактоо болгону үчүн, цитохром-с белогунун кокустан пайда болгонун кабыл алууга мажбур экенин айтууда. Бул ушунчалык чоң бир логикасыздык болгондуктан, бир саамга ойлонуу эволюционисттердин канчалык чоң жаңылыштыкта экенин көрүүгө жетиштүү болот. Мисалы, бирөө сизге келип, Стамбулда Таксим майданындагы таштар күчтүү шамалдын таасири менен сонун бир адам айкелине айланды десе... Же бир аскага урган ири толкундар ал аскада кокустан Иордания-Петрадагы таш усталыгынын эң сонун мисалдары болгон курулуштарды пайда кылган десе, ал адамдын акылы жана муну чындап айтып жатканы жөнүндө кандай ойдо калмаксыз? Көрүнүп тургандай, эволюционисттер булардан да эч мүмкүн эмес болгон пикирди кабыл ала турган даражада акылсыздык кылышууда. Апачык чындыктарды көрмөксөн болушу көпчүлүгүнүн аңдап-түшүнүү жөндөмүн “жаап” койгон. Белок молекулаларынын жашоо үчүн бийик акылга, илимге жана кудуретке ээ Аллах тарабынан долбоорлонгону жана жаратылганы апачык бир чындык.
Белоктордун Өз Кызматына Ылайыкталган Кемчиликсиз Долбоору
Заттарга касиеттерин атомдорунун тартиби берет. Ар бир затты пайда кылган атомдор “молекула” деп аталган өзгөчө топтор абалында тартипке салынган. Жандыктардын түзүлүшүн жана системаларын түзгөн молекулалардын атомдору да жашоого ылайыкташтырылган. Бул өтө маанилүү бир жагдай. Себеби колуңуздагы китептен отурган креслоңузга, өз денеңизден гүлдөрүңүзгө чейин бүт нерселердин баары атомдордон турат. Бирок атомдордун ар кандай формада топтолушу жана уюшушу менен жандуу жана жансыз заттар бир-биринен толук айырмаланышат.
Белоктор жашоону түзгөн төрт чоң негизги молекула тобунун бирөө. (Беркилери нуклеиндик кислоталар, липиддер жана углеводдор.) Ар бир молекула тобунда атомдор ар кандай формада тизилишкен. Мунун урматында ар кандай өзгөчөлүктөргө ээ болушат жана ошол өзгөчөлүктөрүнө жараша кызмат аткарышат.
Молекулалардагы атомдордун жайгашышы ушунчалык аяр жана маанилүү болгондуктан, өтө кыска убакытта, бир даана белок молекуласынын атомдорунун керектүү абалда жайгашпашы денеде оңдолгус бузулууларга себеп болушу мүмкүн. Мисалы, көрүү кубулушун карап көрөлү. Эң алдыңкы камерадан да бир топ жогорку технологияга ээ болгон көздө көрүү кубулушу ишке ашышы үчүн көптөгөн белок кызмат аткарат. Камерада сүрөттөлүш пайда болушунда кызмат аткарган бир канча тетиктер сыяктуу. (Бирок бул жерде бир жагдайды айта кетүү керек: көз менен камера системаларын бир-бирине салыштырууга мүмкүн болгон менен, камеранын тетиктеринин эч качан көздөгү белоктор пайда кылган тунуктуктагы бир сүрөттөлүштү пайда кыла албашы анык. Учурдагы эң алдыңкы технологиялуу камераларга да бул абал тиешелүү.)
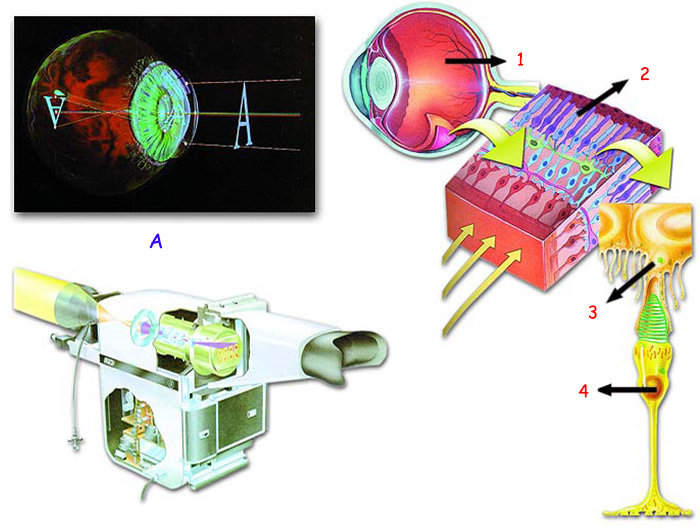
| |
|
A. The picture at the top left is a camera produced to imitate the human eye. (the top left of picture) | |
|
1. Göz, |
3. Melanin proteinleri, |
|
Sol alttaki resim gözün yapısı taklit edilerek tasarlanmış bir kameradır. Yukarıda görülen, yüksek teknoloji ürünü, yüzlerce parçadan oluşan kamera ile elde edebildiğiniz en kaliteli görüntüyü düşünün. Bu görüntüde mutlaka bir pus, karlanma veya kayma olur. Renkler hiçbir zaman aslı gibi canlı ve net olmaz. Bir de sadece protein ve yağlardan oluşan gözünüzün oluşturduğu görüntüyü düşünün. Görüntünüzde hiçbir zaman kayma, kararma, puslanma olmaz. Netlik ayarı hiçbir zaman bozulmaz. Renkler ise hep canlıdır. Onlarca yıldır binlerce bilimadamının, teknik uzmanın ve mühendisin en ileri teknoloji ile oluşturamadığı kalitedeki görüntüyü, şuursuz atomların tesadüfen oluşturmaya başladıklarını iddia etmek akla ve mantığa tamamen aykırıdır. Bu, gözün tüm parçaları ile üstün bir Yaratıcı tarafından yaratıldığının açık bir delilidir. | |
Бул тетиктердин бирөөсүнүн бузук болушу камерада сүрөттөлүштүн пайда болушуна мүмкүнчүлүк бербейт же бузук болушуна себеп болот. Ошол сыяктуу көрүү процессинде кызмат аткарган көптөгөн белоктун бир даанасы да керектүү молекулярдык түзүлүштө болбосо, көрүү процесси бир заматта үзгүлтүккө учурашы мүмкүн. Мисалы, родопсин көздүн жарыкка жооп беришин камсыз кылуучу бир белок. Родопсиндин түзүлүшүндөгү кичинекей эле бир бузулуу бул процессти үзгүлтүккө учуратат. Ошол сыяктуу торчодогу конус клеткаларда жайгашкан жана түстүү көрүүнү камсыз кылган белоктордун түзүлүшүнүн бузулушу болсо түстүү көрүүнү үзгүлтүккө кабылтат. Дагы бир мисал – бул көздү ультра-кызгылт нурлардын зыяндуу таасирлеринен коргоочу меланин белогу өз кызматын аткара албаганда көздө катаракта оорусунун пайда болушу.
Бул мисалдардан да көрүнүп тургандай, белоктордун аларга тапшырылган кызматтарды аткара алышы үчүн эң ылайыктуу молекулярдык түзүлүшкө ээ болушу шарт. Ал үчүн болсо белокторду түзгөн аминокислота молекулалары да эң ылайыктуу абалда жайгашкан болушу зарыл. Аминокислоталардын түзүлүшүндө да белоктордогу сыяктуу кылдаттуу бир долбоор жана кемчиликсиз бир кызмат бар.
Аминокислоталардагы Тартип
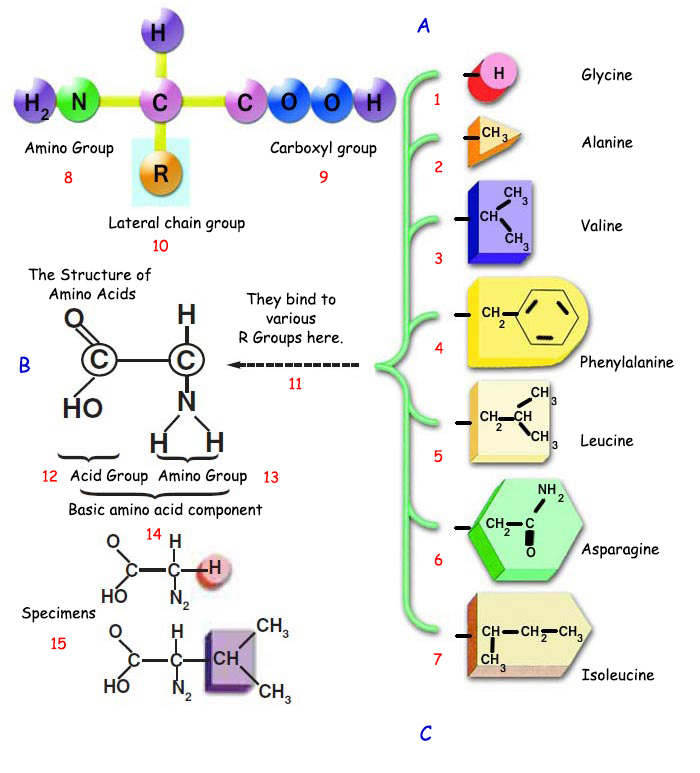
Белоктор аминокислота аттуу молекулалардан турат. Аминокислоталар белокторго караганда кичинекей молекулалар болгонуна карабастан, өтө комплекстүү түзүлүшкө ээ. Аминокислоталарды түзгөн атомдор үч өзүнчө топ абалында болушат; амино тобу, карбоксиль тобу жана каптал чынжыр тобу (же радикалдуу топ).
Бүт аминокислоталарда амино жана карбоксиль топтору бирдей. Бир аминокислотаны башкаларынан айырмалуу кылган жалгыз өзгөчөлүк – бул молекулага бир учунан уланган каптал чынжыр тобу. Ал каптал чынжыр топтордун ар аминокислотада ар башка болушу урматында ар бир аминокислота бир-биринен өтө айырмалуу өзгөчөлүктөргө ээ болушат.
| ||
|
A. Amino asitler, amino grubu, karboksil grubu ve yan zincir grubu diye adlandırılan üç atom grubunun bir karbon atomuna bağlanmasıyla meydana gelirler. B. AMİNO ASİTLERİN YAPISI C. Proteinler amino asitlerden oluşurlar. Amino asitler proteinlere göre çok daha küçük moleküller olmalarına rağmen, son derece kompleks yapıları vardır. | ||
|
1. glisin |
6. asparajin |
11. Burada çeşitli R gruplarına bağlanır. |
Бир машинада ар кандай материалдар колдонулуп жаткан сыяктуу, денебиздеги өтө татаал кызматтарды аткара алышы үчүн белок машиналарында да ар кандай өзгөчөлүктөрдөгү материалдар болушу зарыл. Аминокислоталардын каптал чынжыр топторундагы атомдордун формасы, саны жана тизилиши, электрдик заряды, суутек байланышы мүмкүнчүлүктөрүнүн ар түрдүү болушу аминокислоталардын ар түрдүү болушуна мүмкүндүк берет жана бул өтө көп түрдүү материалдан көп түрдүү белок машиналары өндүрүлөт. Мисалы, каптал чынжыр топторунун (+) же (-) заряддуу болушу же зарядсыз болушу аминокислота молекуласынын сууда ээрип же ээрибешин камсыздайт.
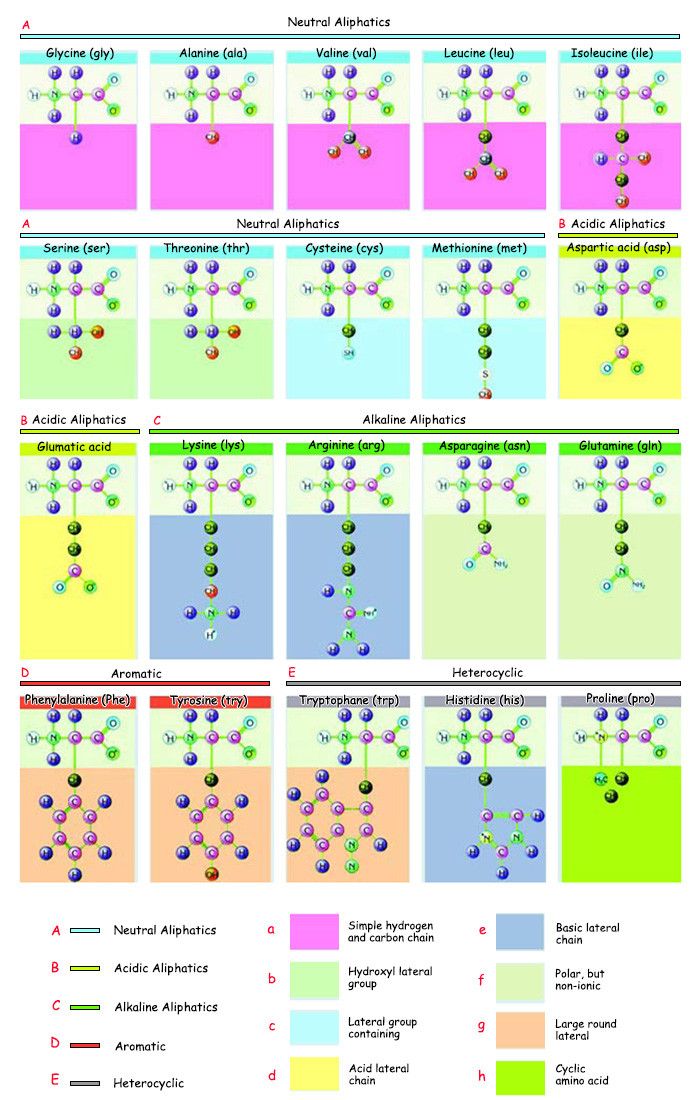
Ушундайча ар түрдүү өзгөчөлүктөргө ээ болгон аминокислоталардын ар кандай абалда тизилиши белоктордун денеде таң калаарлык даражада ар түрдүү кызматтарды аркалашын камсыз кылат. Бирок жандыктардагы аминокислоталарда өтө өзгөчө бир жагдай бар. Табиятта 200дөн ашык аминокислота болгонуна карабастан, белоктор ал аминокислоталардын 20сынан гана пайда болот.
Vücutta bulunan 20 çeşit amino asit | |||
| |||
|
A. Nötr Alifatikler |
a. Basit hidrojen ve karbon zinciri |
e. Bazik yan zincir | |
|
1. Glisin (gly) |
6. Serin (ser) |
11. Glumatik asit (Glu) |
16. Fenilalanin (Phe) |
Белоктордо Эмне Үчүн Табияттагы 200 Аминокислотадан 20сы Гана Колдонулат?
| |
|
1. Pro |
2. Gly |
|
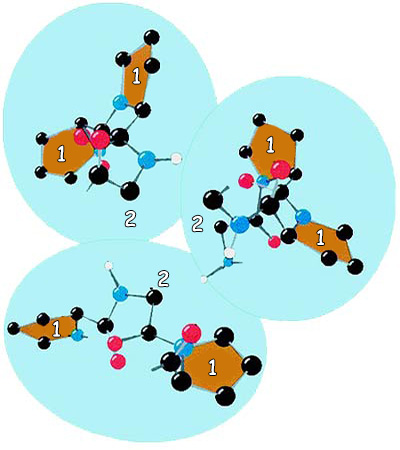
Bu şekilde kolajen proteininin amino asit yapısı görülmektedir. Şekilde de görüldüğü gibi, her üç amino asitten biri glisindir. (Gly)Glisin küçük olması nedeniyle kolajenin yapısı için en uygun amino asittir. | |
Табиятта 200дөн ашуун аминокислота кездешет. Теориялык жактан табиятта бар болушу күтүлгөн аминокислота саны болсо мындан бир топко жогору. Адам денесинде да белоктордо колдонулгандардан тышкары көптөгөн аминокислота дененин зат алмашуу функцияларында колдонулат. Белоктор жанында башка аминокислоталар турса дагы, эмне үчүн атайын ал 20 аминокислотаны тандашат?
Бул суроонун жообун белоктордун түзүлүшү жана функцияларына карап бере алабыз. Себеби жашоо үчүн керектүү болгон белоктор өз кызматын аткара алышы үчүн белгилүү өзгөчөлүктөргө ээ болушу зарыл жана аларга бул өзгөчөлүктөрүн берген эң негизги элементтердин бири – бул аминокислоталар. Мисалы, аминокислоталардын бир бөлүгүнүн гидрофобдук, б.а. сууну түртүүчү бир өзгөчөлүктөгү каптал чынжырларга ээ болушу шарт. Жана ал каптал чынжырлар өтө чоң болбошу зарыл, антпесе аларды белоктун ичине пакеттеп жайгаштыруу мүмкүн болбой калат.
Бир катар аминокислотанын каптал чынжырларынын “спираль” жана “кабат (катмар)” түзүлүштөр катары белгилүү болгон эки өзгөчөлүккө ээ болушу шарт. Себеби ал өзгөчөлүктөр урматында белок үч өлчөмдүү формада боло алат жана алар ал белоктун функциясын аткара алышы үчүн керектүү болгон өзгөчөлүктөр.
Жүргүзүлгөн анализдер натыйжасында белоктордо колдонулган 20 аминокислотанын көпчүлүгүнүн гидрофобдук каптал чынжырлар экени, жарымынын а-спираль жана жарымынын болсо b-катмар өзгөчөлүктөргө ээ экени аныкталган.
Бул 20 аминокислотанын өзгөчөлүктөрүн бир-бирден анализдегенде болсо эмнеге белоктор үчүн атайын тандалганын түшүнө алабыз. Мисалы, эң кичинекей жана эң жөнөкөй аминокислота болгон глицин дагы эң маанилүү белоктордун бири болгон коллаген белогунда өтө маанилүү бир кызматка ээ. Коллагенди түзгөн ар үч аминокислотанын бири глицин, жана кичинекей көлөмү коллаген молекуласынын долбоорунда маанилүү бир роль ойнойт. Себеби бул аминокислота белокту түзгөн чынжырлардын чогуу бекем бүгүлүшүн камсыз кылат. Ал коллаген жипчелеринин чыңалуу каршылыгын жогорулатат. Белгилүү болгондой, коллаген жипчелери болоттон да күчтүүрөөк бир чыңалуу каршылыгына ээ. Эгер ал белокто глициндин ордуна узунураак каптал чынжырлуу башка бир аминокислота колдонулганда, коллаген жипчелери анчалык чыңалуу каршылыгына ээ боло алмак эмес. Ошондой эле, эгер глицин болбогондо, коллаген жипчелери жандыктардын клеткаларын бир-бирине жабыштыра турган күчкө да ээ боло алмак эмес.
Бул жерде кыскача айтылып кеткендей, белокторду түзгөн 20 аминокислотанын табиятта кездешкен 200 аминокислотанын арасынан тандалышында бир акыл жана план бар. Эгер бул тандоо туш келди болгондо, жашоонун уланышы үчүн керек болгон белоктор эч пайда болмок эмес. Бир даана аминокислотанын талап кылынгандан башкача болушу, өтө маанилүү бир функциянын жоголушу деген мааниге келгендиктен, жашоонун эч болбошуна алып келмек.
Көрүнүп тургандай, жашоонун (тирүүлүктүн) ар бир баскычында акылдуу бир долбоор жана акылдуу бир тандоо жана тартип бар.
|
|
|
"alfa -heliks" özelliğine sahip yan zinciri olan amino asit zinciri. |
"beta -tabaka" özelliğine sahip yan zinciri olan amino asit zinciri |
Жандыктардагы Белоктор Сол-Тараптуу Аминокислоталардан Гана Түзүлөт
| |
|
5. Sol Elli Proteinler | 6. Sağ Elli Proteinler |
|
1. Hidrojen | 3. Karbon |
|
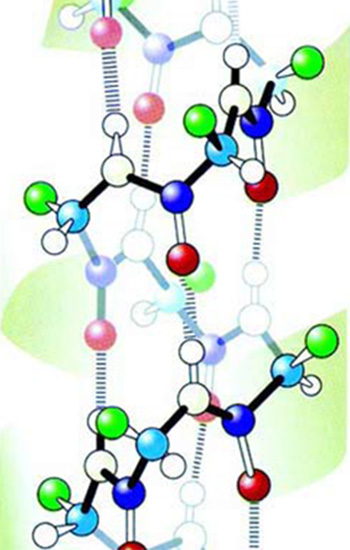
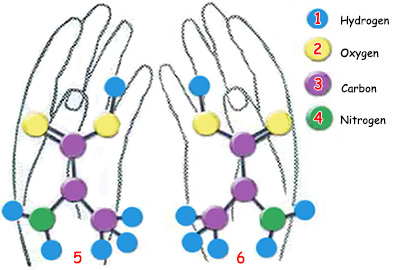
Amino asitler doğada sağ-elli ve sol-elli olmak üzere iki türde bulunurlar. Proteinleri oluşturan amino asitler ise mutlaka sol-elli olmalıdır. | |
Жүргүзүлгөн изилдөөлөр 200 аминокислота түрүнөн 20 даанасынын ар кандай санда жана ар түрдүү тизилишинин белоктордун пайда болушу үчүн жетиштүү эмес экенин көрсөттү. Бүт ал аминокислоталар ошол эле учурда “сол-тараптуу” болушу зарыл.
Табияттагы ар аминокислота түрүнүн оң-тараптуу жана сол-тараптуу болуп эки тиби бар. Бир аминокислотанын экинчисине окшоштугу өзүнүн күзгүдөгү көрүнүшү сыяктуу. Бүт өзгөчөлүктөрү бирдей болгонуна карабастан, оң жана сол мээлей сыяктуу бир-бирине тескери турушат.
Мунун себеби эгиз аминокислоталардын бирөөсүндө амино тобунун көмүртек атомуна сол тараптан, экинчисинде болсо оң тараптан туташышы. Ошентип ар аминокислота эгизинин бирөө сол-тараптуу, экинчиси болсо оң-тараптуу аминокислота деп аталат. Табиятта эки аминокислота түрү тең көп санда жана бирдей көлөмдөрдө кездешет. Жана эки аминокислота түрү тең бирдей жеңилдикте химиялык реакцияга кирип ар кандай кошулмаларды пайда кыла алышат. Б.а. эки аминокислота түрүн бир-биринен айырмалаган жалгыз айырмачылык – бул симметрияларындагы түзүлүш айырмачылыгы.
Бирок жандыктардагы белокторду изилдеген илимпоздор ал белоктордун сол-тараптуу аминокислоталардан гана тураарын байкашты. Жандыктарда бир даана да оң-тараптуу аминокислота жок.
Тереңирээк изилдөөлөр натыйжасында болсо белокторду түзгөн аминокислоталардын баарынын сол-тараптуу болушунун өтө маанилүү бир себеби бар экени аныкталды. Оң-тараптуу аминокислоталар да сол-тараптуулар сыяктуу эле бир-бири менен биригип аминокислота чынжырларын кура алышат, бирок белоктун үч өлчөмдүү формага келишине тоскоол болушат экен. Бирок жандыктардагы белоктордун өз кызматын аткара алышы үчүн, алдыда терең каралгандай, сөзсүз үч өлчөмдүү бир түзүлүштө болушу зарыл. Натыйжада пайдалуу бир белок пайда болушу үчүн бүт аминокислоталардын сол-тараптуу аминокислоталардан тандалышы керек экени, антпесе бир даана оң-тараптуу аминокислотанын аралашып кетишинин дагы белоктун ишке жарай турган формада куралышына тоскоол болоору түшүнүктүү болду.

|
|
Proteinleri oluşturan amino asitlerin tamamının sol-elli olması, binlerce kez havaya atılan bir paranın hep tura gelmesi kadar imkansızdır. |
Жандыктардагы белоктордун сол-тараптуу аминокислоталардан гана тураарынын аныкталышы эволюционисттер үчүн дагы бир маанилүү көйгөйдү пайда кылды. Себеби көрүнүп тургандай, белоктор пайда болушу үчүн бир канча баскычтуу бир тандоо талап кылынат. Биринчиден 200дөн ашуун аминокислота түрүнөн 20 даанасы туура тандап алынышы керек. Ал 20 түр аминокислота болсо сөзсүз сол-тараптуу болушу зарыл. Бир даана туура эмес аминокислотанын аралашып кетиши же туура аминокислотанын оң-тараптуу болуп калышы белокту ишке жараксыз жана бош кылып койот.
Британника энциклопедиясында белоктор үчүн сол-тараптуу аминокислоталардын зарылдыгынын эволюция жагынан бир туюк экени мындайча айтылат:
... Жер жүзүндөгү бүт жандуу организмдердеги белоктор сыяктуу татаал полимерлердин блоктору болгон аминокислоталардын баары бирдей симметрия тибинде. Толугу менен сол-тараптуу сыяктуу. Бул, бир жагынан караганда, миллиондогон жолу абага ыргытылган бир тыйындын экинчи жагы менен эч түшпөстөн, дайыма бир тарабы менен түшүшүнө окшош. Молекулалардын кантип сол-тараптуу же оң-тараптуу болгону толугу менен белгилүү эмес. Бул тандоо түшүнүксүз абалда, дүйнө жүзүндөгү жашоонун булагынан көз-каранды.5
Британника энциклопедиясындагы “бул тандоо түшүнүксүз абалда, дүйнө жүзүндөгү жашоонун булагынан көз-каранды” деген сүйлөмгө токтолуу керек. Эволюционисттер “жашоонун булагы – кокустуктар” деп жактаганы үчүн кокустан болгон окуялардын ушунчалык акылдуу жана туура тандоолор жасашын “түшүнүксүз” деп ойлошууда. Чындыгында болсо, бүт бул акылдуу тандоолор сокур жана аң-сезимсиз кокустуктарга эмес, улуу бир Жаратуучу болгон Аллахка тиешелүү. Эволюционисттер жаратылуу чындыгын кабыл алгылары келбегени үчүн акылга жана логикага сыйбас пикирлерди айтышып, бул тандоо “кокустуктардын” натыйжасы дешүүдө. Ал көз-караш боюнча, белокторду түзгөн аминокислоталар менен аларды пайда кылган атомдор кокустан эң ылайыктуу абалда биригүү чечимин алышкан жана ошентип жашоо үчүн сөзсүз керек болгон белокторду пайда кылышкан. Күмөнсүз, мындай көз-карашты жактоо илим менен акылдан толук алыстоо деген мааниге келет.
Бул темада ыктымалдык эсептөөлөрүн жасаган илимпоздор кичинекей бир белок молекуласынын жалаң гана сол-тараптуу аминокислоталардан туруу ыктымалдыгынын 10210до 1 экенин эсептеп чыгышкан. Математикада 1050дө 1 ыктымалдыгы нөл ыктымалдуулук деп кабыл алынат. 1050 саны 1 санынын жанына 50 даана нөл жазуу менен алынат жана мынчалык чоң бир сандын ичинде 1 ыктымалдык “жок” деген мааниге келет. Демек 1 санынын жанына 210 даана нөл жазуу менен алынган 10210 сыяктуу мындан бир топ чоң сандын ичинде 1 ыктымалдыктын болушу мүмкүн эместин мүмкүн эмеси болуп саналат.6
Белгилүү химик Уолтер Т. Броун (Walter T. Brown) сол-тараптуу аминокислоталардын кокустан чогулуп бир даана белокту да пайда кылышынын мүмкүн эместигин минтип айткан:
Ар кандай аминокислота жансыз заттарда же лабораторияларда синтезделгенде химиялык жактан бир-бири менен бирдей эки формада пайда болот. Ал аминокислоталардын жарымы оң-тараптуу деп аталат, экинчи жарымы болсо сол-тараптуу. Ар бир түзүлүш бир-биринин күзгүдөгү чагылышы сыяктуу. Бирок жандыктардагы, бүт адамдардагы, жаныбарлардагы, өсүмдүктөрдөгү жана бактериялардагы жана ал тургай вирустардагы аминокислоталардын баары сол-тараптуу. Эч бир табигый процесс оң жана сол-тараптуулукту айырмалай албайт. Ошентип сол-тараптуу аминокислоталардан гана турган бир даана белоктун дагы кокустан пайда болуу ыктымалдыгы математикалык жактан нөл.7
Бул жерде көңүл буруу керек болгон жагдай – акылдуу бир тандоонун болуп жаткандыгы; эгер бир тандоо бар болсо, анда сөзсүз “тандоочу”, акылдуу, илимдүү жана аң-сезимдүү бир эрк да болушу зарыл. Мунун ар бир жандыкты эң кичине бөлүктөрүнө чейин бир тартип ичинде курган, бийик акыл, аң-сезим, илим жана кудурет ээси Аллахтын тандоосу экени анык. Куранда да кабар берилгендей;
Асмандан жерге чейин ар бир ишти Ал ороп тартипке салат...
(Сажда Сүрөсү, 5)
Аминокислоталардын Тизилишиндеги План
Белоктор пайда болушу үчүн бул жерге чейин айтылган шарттардын болушу да жетиштүү эмес. Ар бир белок үчүн өзгөчө бир аминокислота тизмеги керек.
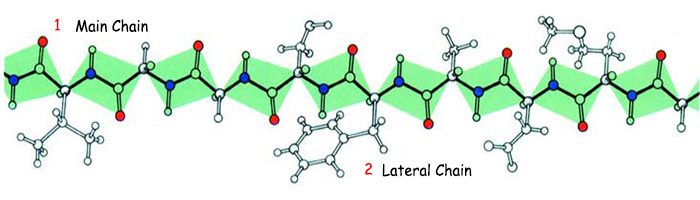
Бир чынжырдын шакектеринин бир-бирине уланышы сыяктуу бириккен аминокислоталар биригээр замат такыр башкача түзүлүшкө айланышат жана белоктордун үч өлчөмдүү формага келишин камсыздашат. Алдыда терең каралгандай, белоктор өз кызматын аткара алышы үчүн үч өлчөмдүү формада болушу шарт. Бирок ал үчүн аминокислота тизмегинде бир даана аминокислотанын да орду алмашпашы, кем болбошу же башка бир аминокислота менен орун алмашпашы зарыл. Себеби бир бөлүкчөнүн да кем болушу же бузулушу ал бөлүкчөнүн бүтүндүн ичиндеги гармониясын бузуп, белокту ишке жарабас түзүлүштө кылып койот. Бул бир сөздүн ичиндеги бир тамганын өзгөрүшү натыйжасында маанинин өзгөрүп кетиши же сөздүн маанисиз болуп калышы сыяктуу. Мисалы, “бал” сөзүн жазып жатканда, бир тамганын туура эмес жазылышы (б ордуна ш жазышылы) менен такыр башка мааниге келген “шал” сөзү келип чыгат. Же бул сөздөн бир тамга чыгарылганда, мисалы л тамгасы чыгарылганда, сөз “ба” болуп калып, эч бир маанини билдирбей калат. Бир сөздөгү бир тамганын орду алмашканда же тамгалардын бирөөсү эле кем болгондо, сөздүн мааниси жоголгон сыяктуу, белоктордо да абал ушундай. Бир даана аминокислотанын эле ордунун алмашышы бүт бир белок молекуласын өз кызматын аткара алгыс кылып салат, б.а. маанисиз бузуп салат. Белок такыр башка бир молекула болуп калат. Себеби ар бир аминокислота сөзгө өзгөчө бир үн кошкон бир тамга сыяктуу белокко белгилүү бир касиет тартуулайт. Ар бир аминокислота – формасы, электрдик заряды, химиялык реакцияларга кирүү абалы жагынан башка башка үндөрдү чагылткан тамгалар сыяктуу.
| |
|
1. Ana zincir |
2. Yan zincir |
|
Şekilde yan zinciri ile birlikte gösterilen bir amino asit zinciri görülmektedir. Bu zincirde yer alan amino asitlerden herhangi birinin yerinin değişmesi veya yerinden çıkartılması, bu protein molekülünü işe yaramaz hale getirir. Dolayısıyla buradaki dizilim kesinlikle rastgele değil, bir tasarım sonucu oluşur. | |
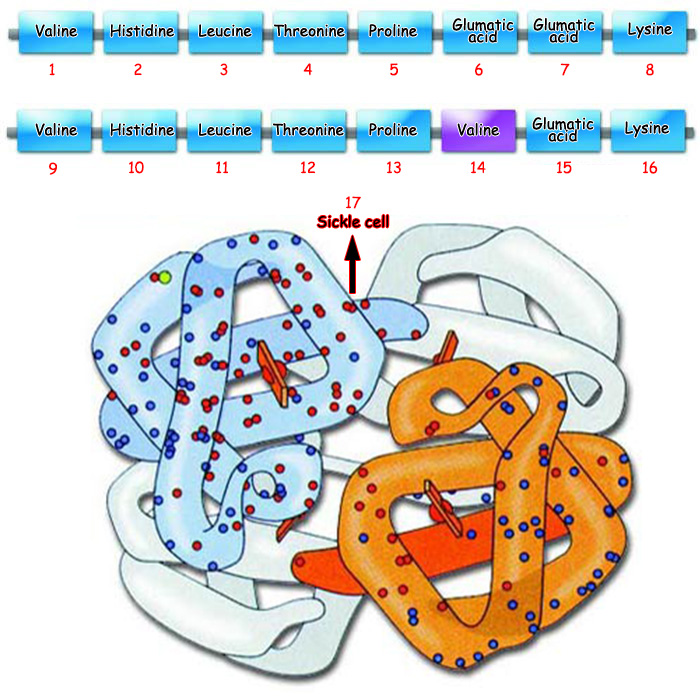
Бир даана аминокислотанын туура эмес же кем жазылышынын денеде кандай орчундуу маселелерге себеп болушу мүмкүн экенине бир кан рагы түрү болгон эритробластикалык анемия оорусун мисал келтирүүгө болот. Белгилүү болгондой, денебиздеги бүт клеткаларга кычкылтек каныбыздагы эритроциттер аркылуу ташылат. Кычкылтек молекуласын ташуу ишин эритроциттердеги болжол менен 600 аминокислотадан турган гемоглобин аттуу белоктор аткарышат. Генетикалык бир оору болгон эритробластикалык анемияга гемоглобиндин түзүлүшүндөгү бир даана аминокислотанын башкача болушу себеп болууда; гемоглобиндеги аминокислота чынжырында “глутамин кислотасы” аттуу аминокислотанын ордуна “валин” аттуу аминокислота өтөт. Ошентип гемоглобиндеги бир даана аминокислотанын туура эмес болушу белокту өз кызматын аткара алгыс, б.а. кычкылтекти ташый алгыс кылып койот. 600 аминокислотанын арасынан бир даана аминокислотанын туура эмес болушунун натыйжасы – көрүнүп тургандай, өлүмгө алып барчу бир оору.
| |||
|
1. Valin |
5. Prolin |
9. Valin |
13. Prolin |
|
Orak hücre anemisi olarak bilinen hastalığın nedeni, hemoglobin proteininde glumatik asitin yerine valin isimli amino asitin gelmesidir. Yandaki resimde de orak hücre anemisi olan hemoglobin proteini görülmektedir. | |||
Эволюция теориясы боюнча болсо, бүт бул аминокислоталар кокустан чогулуп тизилишкен жана анын натыйжасында миңдеген ишке жарактуу жана өтө жогорку сыпаттарга жана функцияларга ээ белок түрлөрү пайда болушкан. Болгондо да бул белоктордун ар бири орду ордунда, керексиз болуп бош калбастан жана бир-бири менен кызматташып өз милдеттерин аткарышууда. Кокустуктардын мынчалык кемчиликсиз тартиптерди, кереметтүү бир план жана программа менен иштеген системаларды курушу эч мүмкүн эмес. Кокустуктар тартипсиздик, башаламандык, хаосту гана пайда кылышат, жогорку бир технологиянын жана улуу бир генийдин чыгармасы болгон машиналарды эч пайда кыла алышпайт. Пайдалуу белоктор пайда болушу үчүн керектүү аминокислота түрлөрүнүн белгилүү бир санда жана белгилүү бир катарда тизилиши керек экени да эволюция теориясынын кокустук пикиринин эч мүмкүн эместигин апачык көрсөтөт. Бул кемчиликсиз тартиптин жалгыз ээси жер жүзүндөгү бүт жандыктарды бүт молекулалары менен бирге жараткан Аллах.
Amino Asitleri Birleştiren Özel Bağlar | |
|
Atomları ve molekülleri birarada tutan çeşitli kimyasal bağlar vardır. Bu bağlar iyonik, kovalent ve zayıf bağlar olarak üçe ayrılır. Bunlardan kovalent bağlar, proteinlerin yapı taşı olan amino asitlerdeki atomları birarada tutarlar. Zayıf bağlar ise amino asit zincirini, katlanarak aldığı özel üç boyutlu biçimde sabit tutarlar. Yani eğer zayıf bağlar olmasa, amino asitlerin biraraya gelmesiyle oluşan proteinlerin üç boyutlu fonksiyonel biçimlerini almaları imkansızdır. Proteinlerin olmadığı bir ortamda ise canlılıktan söz edilemez. | |
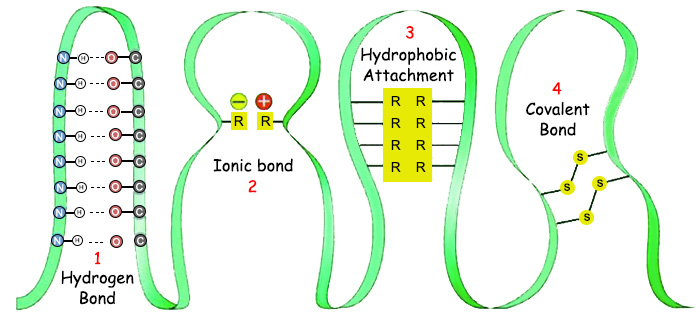
| |
|
1. Hidrojen Bağı |
3. Hidrofobik Birleşme |
|
İşin ilginç yanı ise, hem kovalent bağların hem de zayıf bağların ihtiyaç duydukları ısı aralığının yeryüzünde hüküm süren ısı aralığı oluşudur. Oysa zayıf bağlar ile kovalent bağların yapıları ve özellikleri birbirinden tamamen farklıdır, aynı ısıya ihtiyaç duymalarını gerektiren hiçbir doğal sebep yoktur. Buna rağmen her iki kimyasal bağ da, ancak yeryüzündeki dar ısı aralığı içinde kurulabilir. Eğer kovalent bağlar ile zayıf bağlar farklı ısı aralıklarında işleselerdi, canlılardaki protein oluşumu yine imkansız hale gelirdi. Çünkü proteinlerin oluşumu bu iki kimyasal bağın da aynı anda birlikte kurulmasına bağlıdır. Yani amino asit dizilimini sağlayan kovalent bağların kurulabildiği ısı aralığı, zayıf bağlar için uygun olmasa, protein üç boyutlu son şeklini alamaz, anlamsız ve etkisiz bir zincir olarak kalırdı. Aynı şekilde, zayıf bağların kurulabildiği bir ısıda kovalent bağlar kurulamasa, amino asitler birleşemeyeceği için daha ortaya bir protein zinciri bile çıkamazdı. | |
Аминокислоталарды Бир-Бирине Улаган Көпүрө: Пептиддик Байланыш
Белоктордун пайда болушу үчүн талап кылынган шарттардын бирөөсү – бул туура аминокислоталардын, туура кезекте жайгашышынан тышкары, туура байланыш менен бир-бирине туташышы. Аминокислоталар арасындагы бул байланыш бир көпүрө сыяктуу. Ал көпүрөдө аминокислоталардын бир-бирине туташуу бурчтары, багыттары, ичтериндеги атомдордун түрү жана саны ар бир белок үчүн өзгөчө эсептелген. Мисалы бир белок чынжырындагы эки аминокислотанын арасындагы биригүү бурчунун талап кылынгандан башкача болушу ал көпүрөнүн курулушуна, натыйжада белоктун пайда болушуна тоскоол болот. Натыйжада ишке жараксыз башкача бир молекула келип чыгат. Аминокислоталардын биригишиндеги мындай өзгөчө көпүрөлөр “пептиддик байланыштар” деп аталат.
Жандыктардын химиясын изилдеген илимпоздор жандыктардагы молекулалардын атомдорунун дээрлик баарынын “коваленттик байланыш” деп аталган бир байланыш менен бириккенин билишчү. Бирок изилдөөлөр белокторду түзүү үчүн топтолгон аминокислоталардын араларында мурда белгисиз болгон өзгөчө бир байланыш кураарын көрсөттү. Бул бүт белокторго тиешелүү өзгөрүлбөс бир эреже эле.
Белоктордун пайда болушунда бул байланыштардын мааниси биринчи жолу 1902-жылы Гофмейстер жана Фишер тарабынан ачылган. Бул эки изилдөөчү бул өзгөчө байланыштын бар экенин аныктоо үчүн “биурет” деп аталган бир тест (сыноо) жасашкан.8 Бул тесттин натыйжасында белоктордо кызмат кылган өзгөчө бир байланыштын бар экенин аныкташкан.
Пептиддик байланышты башка байланыштардан айырмалаган эң негизги өзгөчөлүк – бул жылытуу менен же ошого окшогон жолдор менен өтө бат ажырабашы. Пептиддик байланыш жогорку температурада, көпкө чейин күчтүү кислота же базаларга кабылганда гана ажырашы мүмкүн. Белоктордун бекем жана чыдамкай болушун мына ушул пептиддик байланыш камсыз кылат.
Бул өзгөчө байланыш курулушу үчүн бир аминокислотадагы карбоксиль тобу (б.а. ичинде көмүртек, кычкылтек, суутек атомдору болгон өзгөчө молекула) башка аминокислотадагы амино тобу менен (ичинде азот жана суутек атомдору болгон өзгөчө бир молекула) биригиши зарыл. Ошентип белок чынжыры бою байланыш чекиттеринде маанилүү бир тең салмактуулук түзүлгөн болот. Белок молекулаларынын 80%дан көбүн түзгөн бул байланыштын курулушу учурунда суу бөлүнүп чыгат.
Бул жерде төмөнкүдөй суроо пайда болот: дүйнөдөгү бүт жандыктардын молекулалары бир-бирине «коваленттик байланыш» менен байланышса, аминокислоталардын арасындагы байланыштын пептиддик байланыш болушуна эмне шарт түзөт?
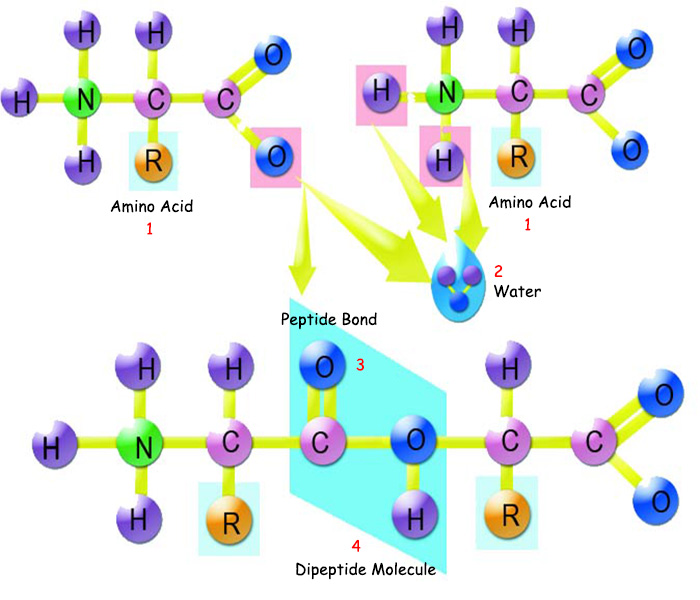
| |
|
1. Amino Asit |
3. Peptid Bağı |
|
Amino asitler birbirlerine peptid bağı ile bağlanırlar. Peptid bağı, diğer bağlardan ayıran en önemli özellik kolay çözülmemesidir. Bu sayede proteinler sağlam ve dayanıklıdırlar. | |
Изилдөөлөр төмөнкүнү көрсөттү: аминокислоталар чогуу турганда араларында түзгөн байланыштардын болжол менен 50%ы гана пептиддик байланыш менен болот, калгандарында болсо башка байланыштар менен бир-бирине туташышат. Ал башка байланыштар менен туташканда болсо белок молекуласы пайда болбойт.9 Туура жана керектүү белоктор пайда болушу үчүн белгилүү түрлөрдөгү аминокислоталардын белгилүү санда, ылайыктуу бир тизилүү менен жана ар бир аминокислотанын сөзсүз сол-тараптуу болушу шарты менен тизилиши зарыл болгон сыяктуу эле, араларындагы байланыш да пептиддик байланыш болушу шарт. Бул шарттардын бирөөсү эле аткарылбаганда же кем болгондо, белок пайда боло албайт. Бул жерде муну да унутпаш керек: орточо бир белок молекуласы бир канча жүз аминокислотадан турат. Ал аминокислоталардын ар биринин экинчиси менен пептиддик байланыш куруу ыктымалдыгы 50%. Ошондуктан бир даана белок молекуласы пайда болушу үчүн жүздөгөн пептиддик байланыш курулушу зарыл жана алардын ар биринин –өз-өзүнчө- түзүлүү ыктымалдыгы 50%.
Бул жерге чейин айтылгандарга таянып, бир даана белоктун пайда болушу үчүн белокторду түзгөн аминокислота чынжырларынын кайсы өзгөчөлүктөргө ээ болушу керек экенин кыскача тизмелейли:
1. Табиятта кездешкен 200дөн ашуун аминокислота түрүнөн 20сы гана жандуу организмдерде кездешет. Ал 200 түрдүү аминокислотадан жасала турган белок үчүн керектүүлөрү тандалып бөлүп алынышы зарыл.
2. Тандалган аминокислоталар оң-тараптуу эмес, сөзсүз сол-тараптуу болушу зарыл.
3. Аминокислоталардын туура жана керектүүлөрү тандалган соң белок пайда болушу үчүн белгилүү кезек менен тизилиши керек.
4. Тандалган аминокислоталар туура тизилген соң аларды бир-бирине улай турган байланыш болсо сөзсүз пептиддик байланыш болушу керек.
Бир даана белок молекуласы пайда болушу үчүн бул шарттардын бир даанасынын да кокустуктар натыйжасында пайда болушу эч мүмкүн эмес. Ошондуктан кокустан ишке ашышы мүмкүн эмес болгон бир канча шарттын кокустан биригип белокторду пайда кылган болушу болсо эч мүмкүн эмес.
|
|
|
Bu cümleyi oluşturan harflerin, bir proteini oluşturan amino asitler olduklarını farzedelim. Bu cümlenin içindeki harfleri rastgele yere attığınızda, bu anlamlı cümleyi oluşturma ihtimaliniz sıfırdır. Böyle rastgele bir harekette milyarlarca farklı sonuçla karşılaşabilirsiniz. Bu ihtimallerden sadece üç tanesi şöyledir: |
|
|
|
1. Herşeyden önce harflerin bir kısmı yere ters olarak düşecektir. |
|
|
|
2. Veya bazı harfler yan, bazıları ters duracaktır. Üstelik harfler atıldıklarında yanyana da durmayabilirler. Yanyana durduklarını farzedelim, bu kez bir kısmı elips, bir kısmı daire şeklinde dizilebilir. |
|
|
|
3. Yanyana durmaları çok küçük bir ihtimaldir. Tüm imkansızlığına rağmen yanyana durduklarını kabul etsek bile, bu sefer de harflerin dizilimleri yanlış olacaktır. Ve böylece ortaya hiçbir anlam ifade etmeyen bir harfler yığını çıkacaktır. Bu örnekte görüldüğü gibi, doğadaki amino asitler rastgele biraraya geldiklerinde kimi sağ-elli kimi sol-elli olacaktır. Üstelik rastgele dizildiklerinde hiçbir anlam ifade etmeyen bir sıralama oluşacaktır ve böylece ortaya protein çıkamayacaktır. Anlamlı bir cümle gördüğünüzde onu yazan akıl, bilgi ve şuur sahibi bir insanın varlığından nasıl emin olursanız, proteinlerin milyarlarca yıldır var olması da onları bilinç ve akıl ile yaratan üstün bir Yaratıcı'nın varlığını göstermektedir. |
Молекулярдык биологдор тарабынан белоктордун кокустуктар натыйжасында пайда болуу ыктымалдыгынын жок экени жөнүндө көптөгөн ыктымалдык эсептөөлөрү жасалган. Ал илимпоздор арасында Гарольд Моровиц, Фред Хойл, Илья Пригожина, Хьюберт Йоки жана Роберт Сауэр сыяктуу белгилүү илимпоздор бар. Бул илимпоздор, эволюционист болгонуна карабастан, белок сыяктуу макромолекулалардын кокустан пайда болуу ыктымалдыгы эч жок деген жыйынтыкка келишкен.
Узундугу 100 аминокислота болгон кичинекей бир белок молекуласынын кокустуктар натыйжасында пайда болуу ыктымалдыгынын жок экенин төмөнкүдөй математикалык эсеп менен көрө алабыз:
100 аминокислота узундуктагы бир белокто бүт аминокислоталардын кокустуктар натыйжасында сол-тараптуу болуу ыктымалдыгы болжол менен (1/2)100 же 1030да 1 ыктымал. Жандыктардагы белоктордо 20 аминокислота болгону үчүн, белокту түзгөн аминокислота чынжырынын белгилүү бир аймагында белгилүү бир аминокислотанын жайгашуу ыктымалдыгы 1/20. 100 аминокислота узундуктагы белгилүү бир белокту алуу ыктымалдыгы (1/20)100 же болбосо 10130да 1. Белгилүү бир аминокислота чынжырында пептиддик байланыш алуу ыктымалдыгы болжол менен 50%. Ичиндеги бүт байланыштар пептид болгон 100 аминокислоталык бир чынжыр алуу ыктымалдыгы болжол менен (1/2)100 же 1030да бир ыктымал. Бул дээрлик нөл дей турганчалык аз бир ыктымалдык.
Эми бүт бул ыктымалдык эсептөөлөрүн эске алып, бүт байланыштар пептид байланыш болгон, бүт аминокислоталар сол-тараптуу болгон жана аминокислоталар белгилүү бир белок үчүн атайын бир катарда тизилген 100 аминокислота узундуктагы бир чынжырдын кокустан пайда болуу ыктымалдыгынын канча экенин карайлы. Бул ыктымалдык болжол менен 10190до 1 болот. Мындай бир ыктымалдык ишке ашышы үчүн дүйнөнүн өмүрүндөй узун убакыт берилсе дагы, иш жүзүндө андай белоктун пайда болуу ыктымалдыгы нөл. Мындан тышкары, математикалык жактан 1050дө бир ыктымалдыктын “нөл” экенин да эске алсак, мунун кокустан пайда болуу ыктымалдыгынын эч мүмкүн эмес экенин апачык көрө алабыз. Ал тургай, 10190 санынын 1050 санынан болжол менен 4сүнө барабар экенин эске алсак, мунун канчалык мүмкүн эместигин жакшыраак түшүнөбүз. (1050.1050.1050.1040=10190) Бул жыйынтыктарга таянып дүйнөгө белгилүү биохимик Майкл Бихи (Michael Behe) 100 аминокислота узундуктагы бир белокто талап кылынган бир тизилүүнү алуу ыктымалдыгынын көздөрү жабык бир адамдын 8 600 000 километр квадрат аянттуу Сахара чөлүндөгү белгиленип коюлган бир даана кумду табуу ыктымалдыгынан да бир топ төмөн экенин айткан.10
Бир даана белоктун да кокустан пайда болушунун мүмкүн эместин да мүмкүн эмеси экени көрүнүп турат, демек жандыктардын денесинде кызмат кылган миңдеген түрдүү белоктун кокустан пайда болуп, биригип клеткаларды пайда кылган деп айтуунун канчалык логикасыз экени апачык бир чындык. Болгондо да, клеткада бир гана белоктор кызмат кылышпайт. Клетка бийик бир акыл менен жаратылган белоктордун жана башка молекулалардын акыл жана теңдешсиз бир план менен уюшуусунан түзүлөт. Клетканын планы ичинде эч бир молекула максатсыз өндүрүлбөйт, ар биринин өз өзгөчөлүгүнө ылайык бир кызматы бар.

|
|
Prof. Michael Behe, 100 amino asit uzunluğundaki bir proteinde uygun bir dizilim elde etme ihtimalinin, gözleri kapalı birinin Sahra Çölü'nde, işaretlenmiş tek bir kum tanesini bulma ihtimalinden bile çok daha az olduğunu söylemiştir. Bu örnek dahi, proteinlerin üstün bir aklın ve bilincin sahibi olan Allah tarafından yaratıldıklarının bir göstergesidir. |
Белоктун пайда болушунун ар бир баскычында бир акыл, илим, эрк, аң-сезим, кудурет жана долбоордун бар экени апачык көрүнүп турат. Булар болсо улуу бир Жаратуучу болгон Раббибизге тиешелүү өзгөчөлүктөр. Аллахтан башка, алсыз жана эч нерсеге күчү жетпеген кокустук сыяктуу түшүнүктөрдү же нерселерди жаратуучу деп кабыл алгандар чоң жаңылыштыкта жана адашууда. Аллах бир аятында мындай дейт:
Асмандардын жана жердин мүлкү Ага тиешелүү; (Ал) балалуу болгон эмес.
Ага мүлкүндө орток жок. Бүт нерсени жараткан, ага бир калып берген, белгилүү бир өлчөө менен жараткан.
Аны койуп, эч нерсе жаратпаган, тескерисинче өздөрү жаратылган,
өздөрүнө да зыян да, пайда да жеткире албаган, өлтүрүүгө,
жашатууга жана кайрадан тирилтип-жайууга күчтөрү жетпеген
бир топ кудайларды (кудай) тутунуп алышты.
(Фуркан Сүрөсү, 2-3)
Белоктордун Төрт Түрдүү Түзүлүшү
Белоктордун физикалык, химиялык жана биологиялык өзгөчөлүктөрүн жана ал өзгөчөлүктөр урматында аткара турган кызматтарын алардагы аминокислоталардын түрү, катары жана ал аминокислоталардын каптал чынжырындагы тартиптер аныктайт. Белоктор
1. биринчи
2. экинчи
3. үчүнчү жана
4. төртүнчү болуп төрт түрдүү түзүлүштө болушат.
Биринчи (primary) түзүлүш түз аминокислота чынжырынан пайда болот. Белок биринчи түзүлүш кезинде эч кызмат аткара албайт. Экинчи, үчүнчү же төртүнчү түзүлүштөрдүн бирөөсүнө кошулганда гана бир катар иштерде роль аткара алат.
Экинчи (secondary) түзүлүш узун аминокислота чынжырынын бир спираль абалында оролушу менен пайда болот. Актин, миозин, фибриноген, кератин жана бета-каротин сыяктуу белоктор экинчи түзүлүштө.
Үчүнчү (tertiary) түзүлүштөгү белоктор аминокислота чынжырынын жүн түйдөгүнө окшош абалда кабатталып, бүгүлүшү жана ар кандай туташышы менен пайда болот.
Төртүнчү (quaternary) түзүлүш болсо тең же ар кандай көлөмдөгү эки же андан көп аминокислота чынжырынан турат. Бул түрдүү түзүлүштөрдүн өзгөчөлүктөрүн жана белокторго тартуулаган функцияларды тереңирээк кароо бул молекулалардын канчалык улуу жаратуу мисалы экенин көрүшүбүзгө көмөкчү болот.
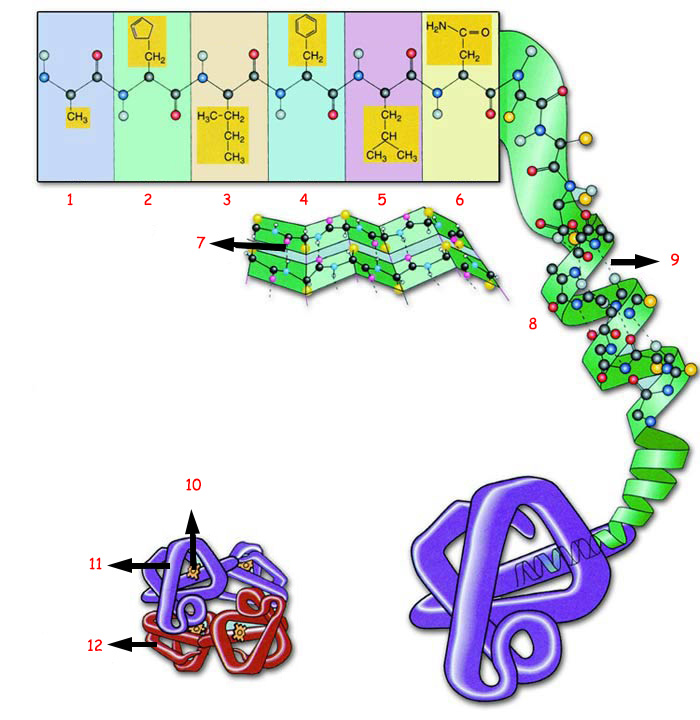
| |||
|
1. Amino Asid 1 |
4. Amino Asid 4 |
7. Hidrojen Bağı |
10. Heme Grubu |
|
1) PRİMER YAPI: Belirli sayı, şekil ve düzendeki amino asitler bir zincir oluştururlar. 2) SEKONDER YAPI: Amino asit zinciri bir sarmal şeklinde kıvrılır. Bunun nedeni her amino asitin yanındaki ile oluşturduğu hidrojen bağıdır. 3) TERSİYER YAPI: Amino asit zinciri yün yumağını andırır şekilde katlanır, bükülür ve çeşitli bağlarla bağlanır 4) KUATERNER YAPI: Katlı protein zincirleri birkaç alt parçanın biraraya gelmesiyle tek bir protein oluşturur. | |||
|
Proteinlerin fiziksel, kimyasal ve biyolojik özelliklerini ve bu özellikler sayesinde yerine getirecekleri görevlerini, onları oluşturan amino asitlerin bu şemada gösterilen yapıları belirler. | |||
Муну эстен чыгарбаш керек: белоктордун түзүлүшү жөнүндө бүт биология же биохимия китептеринде ушул сыяктуу маалыматтарды ала аласыз. Бирок бул темалардын бул китепте баяндалышынын себеби – белокторду түзгөн түзүлүштөрдүн, факторлордун, системалардын канчалык комплекстүү жана татаал экенин көрсөтүү. Кээ бир эволюционисттер белоктор кокустан пайда болгон дешип, белоктордун түзүлүшүн өтө жөнөкөй жана кокустан пайда болушу мүмкүн сымал баяндоо жолун тандашат. Себеби белоктордогу өтө комплекстүү түзүлүштү жашырганда гана адамдарды кокустук жомогуна ишендире алабыз деп ойлошот. Ушул себептен белоктордун түзүлүшүн айтып берип жатканда аминокислоталардын мончоктун шурулары сыяктуу жөнөкөй гана бир-бирине туташышы менен белоктордун пайда боло алышы сыяктуу бир услуп колдонушат. Чындыгында болсо, бул жерге чейин айтылгандардан да көрүнүп тургандай, белоктор пайда болушу үчүн аминокислоталардын туш келди туташышы жетиштүү болбойт, көптөгөн шарттар бир учурда чогуу аткарылышы зарыл. Жана ал шарттар аткарылбаса ишке жарактуу белоктор пайда болбойт. Ошондуктан төмөндөгү маалыматтарды окуп жатканда, кокустуктардын мынчалык кылдат пландарды, эсептерди жасай албашын, аминокислоталарды атайын форма жана ыкмалар менен бир-бирине улай албашын эсте тутуп ой жүгүртүү зарыл.
Белоктордун Биринчи Түзүлүшү: Аминокислота Тизилиши
Белоктордун жашоо үчүн өтө маанилүү болгон формаларынын эң негизги аныктоочусу – бул белокторду түзгөн аминокислоталардын тизмеги. Аминокислота тизмегинин туура эмес болушу көптөгөн генетикалык оорунун себеби болот. Ушул себептен белоктордун биринчи түзүлүшү, б.а. аминокислоталардын туура тизилиши өтө маанилүү.
Аминокислота тизмеги белок үчүн “омуртка” кызматын аткарат. Ар бир белок түрүнүн омурткасы ал үчүн атайын жаратылган. Омурткалуу жаныбарларда омуртканын дененин формасын аныкташы сыяктуу, белоктордун омурткалары белоктордун формаларын аныктайт. Ар бир аминокислота болсо омурткадагы бир шакек сыяктуу. Дене өз кызматын аткара алышы үчүн ар бир омуртка шакегинин омурткада белгилүү бир жерде болушу зарыл болгон сыяктуу, ар бир аминокислота да белоктогу кээ бир өзгөчөлүктөр пайда болушу үчүн белгилүү бир жерде жайгашышы керек.
Белоктордогу омуртканы денебиздеги омурткага салыштырганыбызда кылган иштери жагынан өтө окшошкону менен ортодо бир айырма бар. Белоктордун омурткалары миллиметрдин миллиондон бириндей бир жерде кызмат аткарышат. Мынчалык кичинекей бир жерде ушунчалык маанилүү бир механизмди түзө алган бир омуртка – албетте, өтө бекем жана кереметтүү бир түзүлүш.
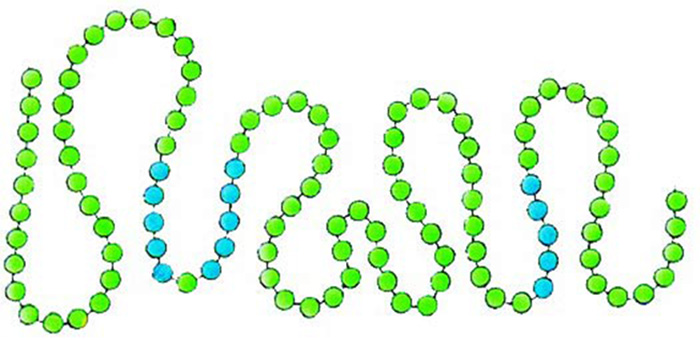
|
|
Amino asitlerin tesbih taneleri gibi belli bir sırada yanyana dizilmeleri ile proteinlerin primer yapıları oluşur |
Бул жерде көңүл буруу керек болгон дагы бир өтө маанилүү жагдай бар. Денебиздеги омурткадагы сыяктуу белок омурткасынын шакектери, б.а. аминокислоталар да бир-бири менен эң ылайыктуу абалда биригүү үчүн өзгөчө формада жаратылышкан. Омуртка шакектеринин бир-бирине кемчиликсиз уланышы омуртканын иштеши жагынан канчалык маанилүү болсо, белоктордо да дал ушундай. Бир эле аминокислота кийинки аминокислотага туура катар менен уланбаса, белок бүт функциясын жоготот. Бул жердеги кылдат жана акылдуу жаратууну көрүү үчүн бир аз ойлонолу.
Миллиметрдин миңден бири көлөмүндөгү клеткаларыбыздын ичинде, б.а. көз менен көрүүгө мүмкүн болбогон даражадагы кичинекей бир жерде өтө кереметтүү окуялар болуп жатат. Клетканы түзгөн миңдеген белок менен ал белокторду түзгөн жүздөгөн аминокислота бир дагы катасыз өз-өз орундарында жайгашышат. Жана бул ар бир адамдагы триллиондогон клеткада мына ушундай, жана дүйнөдөгү миллиарддаган адамдын ар биринде баары өз-өз ордунда. Мынчалык кереметтүү бир окуя, эволюционисттер айткандай, кокустуктардын натыйжасы эмес. Ошондой эле, аминокислота деген нерселердин көзү, кулагы, ойлонуу жөндөмү болгон аң-сезимдүү жандыктар эмес экенин да унутпаш керек. Бул нерселер – белгилүү сандагы атомдун биригишинен пайда болгон кичинекей молекулалар. Б.а. аминокислоталар негизи аң-сезими, акылы жок атом жыйындылары. Андай болсо, жашоо үчүн керектүү болгон бир белоктун кантип пайда болоорун, кайсы аминокислотанын каерге жайгашаарын чечкен ким? Аминокислоталардын ичиндеги атомдор бир күнү чогулуп чечим кабыл алышып, биз мындай катар менен биригип “бир аминокислота пайда кылалы, анан биз сыяктуу башка аминокислоталарды түзгөн атомдор менен келишип белгилүү бир катарда тизилели жана ошентип бир белокту пайда кылалы” деген болушу мүмкүнбү? Албетте, бул өтө акылсыз бир ой.
Аң-сезимсиз атомдор мындай бир жөндөмдө боло албаган сыяктуу эле, алар биригип пайда кылган аминокислоталардын жана алар чогулуп пайда кылган белоктордун да мындай бир чечим алуу механизми жок. Бүт буларды эң ыңгайлуу жерлерге жайгаштырган, ушундайча жандуу клеткалардын курулуш материалы болгон белокторду пайда кылган жана ал клеткалар менен жер жүзүндө кемчиликсиз жана сансыз түрдүү бир жашоону пайда кылган – бул Аллах. Аллах атомдордон ири галактикаларга чейин бүт ааламдардын Рабби.
Белоктордун Экинчи Түзүлүшү: Спираль Жана Кабаттуу Түзүлүш
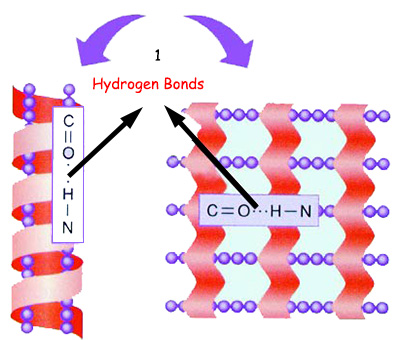
|
|
hidrojen bağları |
|
Amino asitler birbirleriyle peptid bağ dışında bir de hidrojen bağları ile bağlandıklarında, protein zinciri sarmal veya tabakalı bir yapıya sahip olur. Bu, proteinin sekonder yapısı olarak adlandırılır. |
Бир белок үчүн керектүү болгон аминокислоталар катары менен тизилген соң башка кереметтүү окуялар да ишке ашат жана ар бир аминокислота жанындагы аминокислота менен түзгөн пептиддик байланыштан тышкары суутек байланыштарын да түзөт. Бул байланыштардын түзүлүү формасы аминокислоталардын тизмек боюнча ала турган формасын жана позициясын аныктайт. Мисалы, кээде аминокислота өзү жайгашкан чынжырда суутек байланыштарын түзгөндө спираль бир түзүлүштү пайда кылат. Аминокислоталар өздөрү жайгашкан чынжырдан башка бир аминокислота менен алсыз байланыштар түзгөндө болсо тепкичтерге окшош кабаттуу түзүлүштөрдү пайда кылат.
Чынжырлары спираль формасында болгон белоктор телефон шнуруна окшошот. Дал телефон шнуру сыяктуу бир октун айланасында бир линияны бойлой оролушат. Чачтагы белоктор менен бир булчуң белогу болгон миозин ушундай спиральдык түзүлүштө жана мунун натыйжасында ийкемдүү. Себеби суутек байланыштары үзүлө алат жана оңой гана кайра түзүлө алат.
Күнүмдүк жашообузда суутек байланыштарынын дене белокторуна болгон таасирин үйрөнүү натыйжасында ар кандай мүмкүнчүлүктөр пайда болду. Мисалы, тармал чачтарды түздөө же түз чачтарды тармалдаштыруу үчүн чач белокторундагы аминокислоталар арасындагы суутек байланыштары бузулат же жаңы байланыштар түзүлөт.11
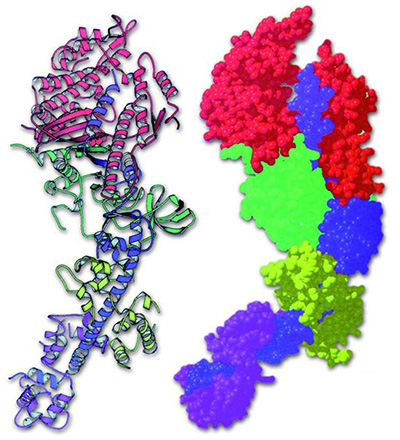
|
|
Yukarıdaki resimde bir kas proteini olan miyosinin yapısı görülmektedir. Sekonder yapıya sahip olan miyosin, sarmal yapıdadır ve bu nedenle elastiktir. Bunun nedeni amino asitler arasında oluşan hidrojen bağlarının kırılabilir olmasıdır. |
Экинчи түзүлүшү тепкич сыяктуу кабат формасында болгон белоктор болсо спираль формадагылар сыяктуу ийкемдүү болушпайт. Бирок көп жандыктын өтө негизги муктаждыктарынын бири болгон ийилүү кыймылына мүмкүнчүлүк берген түзүлүштөрдүн пайда болушун камсыз кылышат. Мисалы, жибек курттун жипчелери жана жөргөмүш тору сыяктуу башка белоктор параллельдүү тизилген жана бир-бирине суутек байланыштары менен туташкан чынжырлардан турат. Ал белоктордун омурткасы бир токуу модели сымал төмөн жогору ийрилет. Мунун себеби – пептид атомдорунун белок чынжырына тик абалда уланышы.12 Мунун урматында бул модельдеги белоктор ийкемдүү болуунун ордуна түз жана ийилген болот.
Белоктордогу ийилүүлөр жандыктардын денелеринде дайыма керектүү жерлерде болушат. Жөргөмүш тору белоктору болгон фиброиндер ийилүү өзгөчөлүгүнө ээ болбогондо, жөргөмүш токуган торлор ишке жарамак эмес. Себеби ал белоктун түзүлүшү жөргөмүш торлоруна олжосунун качышына тоскоол боло турган бир бекемдик кошот. Мунун урматында жөргөмүш тору өз жоондугундагы (диаметри 1 милиметрдин миңден бири) бир болоттон 5 эсе бекемирээк болуп калат.13
Көрүнүп тургандай, белоктордун түзүлүштөрү жандыктардын жашоосун улантышы үчүн эң майда-баратына чейин, кемчиликсиз жана теңдешсиз пландалган. Эч бир сокур кокустук, ааламдагы атомдордун баары ага баш ийдирилсе да, мынчалык терең ойлонуп, келечекти ойлоп, кемчиликсиз эсептер менен пландарды жасай албайт. Эч бир атом же кокустан болгон эч бир окуялар жыйындысы жөргөмүш тору эң колдонууга ыңгайлуу абалга келиши үчүн бүт атомдорду уюштуруу жөндөмүнө, илимине жана акылына ээ эмес. Мунун тескерисин жактоо болсо чоң акылсыздык.

| |
|
Altta ipek fibroinlerinin üç boyutlu yapısı görülmektedir. Koza ipeğinin lifleri ve örümcek ağı gibi proteinler paralel olarak sıralanmış ve birbirlerine hidrojen bağı ile bağlanmış zincirlerden oluşurlar. Bu sayede düz ve bükülgen olurlar. Örümceklerin yaşamı ise ördükleri ağların bu özelliğine bağlıdır. | |
|
1. Ala |
2. Gly |
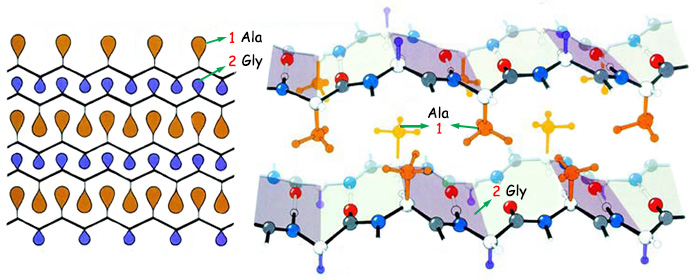
| |
Белоктордун Үчүнчү Түзүлүшү
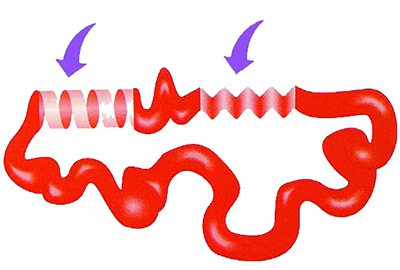
|
|
Proteinler sekonder yapılarında aldıkları şekilden sonra bükülmeye, katlanmaya ve ani dönüşlerle yeni şekiller oluşturmaya başlarlar. Bu şekilde proteinlerin tersiyer yapısı oluşur. |
Белоктор экинчи түзүлүшүндө алган формадан соң бир-бирине жакындаган же алыстаган аминокислоталардын таасири менен ийилип, кабатталып жана кээде кокус бурулууларды жасап жапжаңы формаларды алып башташат. Жана ушундайча белоктун функциясы үчүн өтө маанилүү болгон үч өлчөмдүү форманы түзүшөт. Мындай ийилүүнүн же кабатталуунун себеби аминокислоталардын каптал чынжырларынын арасындагы өз ара таасирлер. Ал өз ара таасирлер натыйжасында бүт жандуу системалардын иштей алышы үчүн ушунчалык маанилүү болгон ийилүү процесси кантип ишке ашат?
Белоктордогу аминокислоталардын каптал чынжырлары кээ бир таасирлер натыйжасында бир-бирин тартышат же түртүшөт. Бул тартуу жана түртүү кыймылынын пайда болушунда беш негизги фактор роль ойнойт. Бул беш фактор – суутек байланыштары, дисульфиддик байланыштар, иондук байланыштар, Вандер Ваальс күчтөрү жана каптал чынжырлардын башка өз ара таасирлери полярдык жана полярдык эмес таасирлер.
Бул өзгөчө байланыштар урматында аминокислоталардын кээ бир бөлүктөрү бир-бирине жакындайт, аминокислота чынжыры өзүнүн үстүнө кабатталат, белоктордун белгилүү убакыт жана бурчтар менен ийилүүлөрү камсыздалат, белок молекуласынын үч өлчөмдүү түзүлүшү тең салмактуу сакталат жана клеткадан тышкаркы чөйрөдө майдаланышынын алды алынат.
Жасалган эксперименттер бул байланыштардын өтө критикалуу мааниге ээ экенин көрсөттү. Себеби бул байланыштардын ар бири белок молекуласы бою ар кайсы аймактарда алдыңкы планга чыгышып белоктун дал талап кылынган формага киришин камсыздашат. Мисалы бир белоктун белгилүү аймактарында гана түзүлгөн дисульфиттик байланыштар ал аймактарда өзгөчө бир ийилүүнү камсыздайт; болгондо да ошол аймакта канча муктаждык болсо ошончолук чоңдукта... Ошол сыяктуу башка күчтөр дагы белоктун белгилүү аминокислота аймактарында белгилүү убакыттарда кызмат кылышып чынжырдын кээ бир бөлүктөрүнүн бир-биринен алысташына, кээ бирлеринин болсо жакындашына себеп болушат. Бир белоктун талап кылынган формасындагы ийилүүлөр менен бүктөлүүлөрүнүн кандайдыр бирөөсүнүн болбошу ал белокту ишке жараксыз кылып койот.
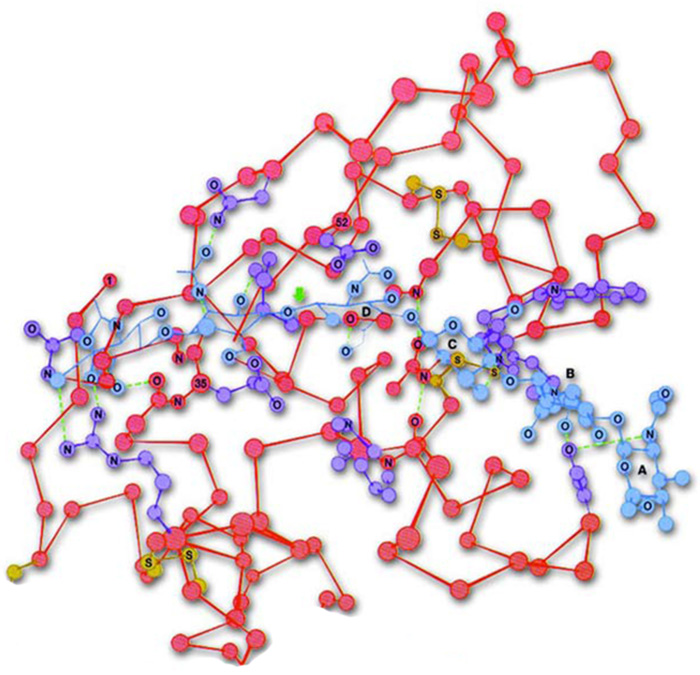
|
|
Lizozom proteinin üç boyutlu şekli |
Байланыштардын Күчү Эң Ылайыктуу Болушу Керек
Белоктор пайда болушу үчүн керектүү болгон байланыштар белгилүү болгон башка күчтүү байланыштардан айырмалуу. Башка күчтүү химиялык байланыштар менен белоктордун үч өлчөмдүү ийилген формага келиши мүмкүн эмес. Себеби курула турган байланыштын күчү молекулалардын бир-бирине ашыкча жакындашына, натыйжада белоктун касиетин жоготушуна себеп болот. Ошондуктан бүт өзгөчөлүктөрү жана күчтөрү атайын аныкталган бул байланыштар белоктордун ийилиши (бүктөлүшү) үчүн эң идеалдуу.
Ошондой эле, белоктордун иштөө ылдамдыктары да ушул байланыштар урматында камсыздалат. Белгилүү биолог Дж. Уотсон (J. Watson) бул жөнүндө мындай дейт:
Бир белок болгон фермент комплекстери кандайдыр бир температура өзгөрүшүндө өтө бат бириге алат же бөлүнө алат. Бул чындык ферменттердин эмнеге мынчалык күчтүү иштешин түшүндүрөт. Кээде ушунчалык бат болуп, секундасына 106 жолу бул ишти жасай алышат. Эгер ферменттер бир-бирине күчтүүрөөк байланыштар менен уланган болгондо, бир топ жай кыймылдашмак.14
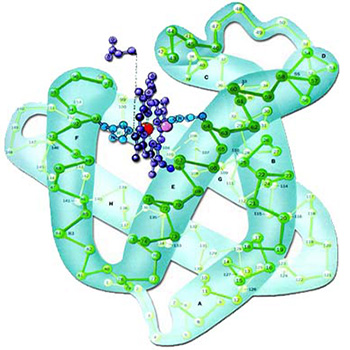
|
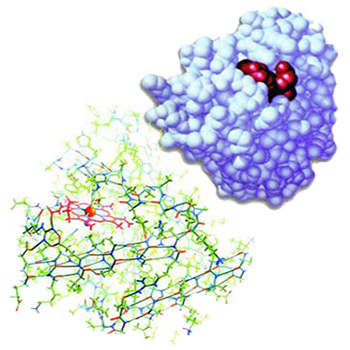
|
|
Miyoglobin proteininin üç boyutlu yapısı ve atomları arasındaki peptit grupları görülmektedir. |
Miyoglobin proteininin üç boyutlu yapısı, kompleksliği çok iyi vurgulayacak şekilde görülmektedir. Kuşkusuz böyle önemli fonksiyonları yerine getirebilen mükemmel bir yapının tesadüflerle oluşması kesinlikle imkansızdır. |
Белоктун Үч Өлчөмдүү Формасы Кемчиликсиз Бир Долбоордун Натыйжасы:
Белок чынжырындагы мындай ийилүүлөрдүн формасы, убактысы, орду, багыты жана бурчунун маанисин элестетүү үчүн бир мисал берели. Бул кылдат форманы белгилүү бир Япон оюнуна (оригами) окшотууга болот. Бул оюнда үч өлчөмдүү бир форманы алуу үчүн эки өлчөмдүү бир кагаз белгилүү бир кезек менен бүктөлөт.
Алдын-ала атайын даярдалган бир бүктөө буйругун аткаруу менен бир кеме макетин же бир куш макетин жасай аласыз. Бир белоктун үч өлчөмдүү бир формада бүктөлүшү үчүн да аминокислота чынжырынын белгилүү бир убакыт аралыктары менен жана белгилүү жерлерде, белгилүү өлчөмдө, белгилүү бурчтарда жана багыттарда бүктөлүшү зарыл. Белоктор ал оюндагы үч өлчөмдүү формалар сыяктуу. Ал оюндун аягында келип чыгышы пландалган формаларды туш келди бүктөөлөр менен алууга болбойт. Себеби ал оюнда кагаздын кайсы бөлүгүнүн кандай кезек менен, канчалык жана кандайча бүктөлөөрү, аягында алына турган бир форма үчүн алдын-ала, бул багыттагы адистер тарабынан долбоорлонот. Бир эле бүктөөнүн туура эмес кезек менен, туура эмес багытта же туура эмес өлчөмдө жасалышы пландалган форманы алууга жолтоо болуп, натыйжада бузук жана маанисиз бир форма келип чыгат. Мисалы, учак формасын алуу үчүн талап кылынган кезектүү бүктөөлөрдүн бирөөсүн кем кылганыңызда же башка бир багытты көздөй бүктөгөнүңүздө, учактын канаты пайда болбойт. Машина формасын алам деп жатып туура эмес бүктөө натыйжасында машинанын дөңгөлөктөрү пайда болбой калат. Белоктордо болсо абал мындан бир топ татаал. Бир белок молекуласындагы бир эле аминокислотанын туура эмес катарда же туура эмес бир багытта биригиши белоктун туура эмес форма алышына жана натыйжада ишке жараксыз болуп калышына себеп болот. Мисалы, булчуңдарда кычкылтек ташуу кызматын аткарган миоглобин белогунун тоголок формасы бузулганда узуну туурасынан 20 эсе узун абалга келип, өз кызматын аткара алгыс болуп калат.15

|
|
Protein zincirindeki bükülmeler bilinçli bir tasarımın eseridir. Bunu bir kağıdın özel katlama talimatlarını izleyerek bir gemi veya bir kuş maketine dönüştürülmesine benzetebiliriz. Tek bir yanlış katlanma dahi sonuçta bir kuş maketi elde edilmesini engelleyecektir. Elbette bir proteinin oluşumu için gereken katlanmalar, bundan çok daha komplekstir ve tesadüflerle oluşması kesinlikle imkansızdır |
Өзү жалгыз же чогуу турганда эч нерсеге жарабаган аминокислоталар ушундай бүгүлүүлөр жана ийилүүлөр натыйжасында өзгөчө мааниге ээ болуп, дененин ичинде өтө маанилүү кызматтарды аткарышат. Түз бир кагаздын акылдуу, пландуу жана бир долбоордун негизинде ийилип, бүктөлүшү менен бир кеме же учак формасына келип, бир маанини билдириши сыяктуу... Бул жерде муну да белгилей кетүү керек: белоктун түзүлүшү пландуу бүктөө менен алынган кагаз формадан бир топ комплекстүү жана уюшкан. Болгондо да, белок молекуласы көзгө да көрүнбөй турган, ал тургай, электрондук микроскопто да аныктоо мүмкүн эмес даражада кичинекей. Ошончолук кичинекей бир жерге батырылган атомдор алгач бир план жана долбоорго ылайык тизилишип, анан кайра ал план жана долбоорго ылайык бүктөлүп ийилүүдө. Булардын баары биз билип-көргөн эч бир долбоорго салыштырылгыс даражада кереметтүү жана өтө таң калыштуу өзгөчөлүктөр.
Мынчалык кемчиликсиз, комплекстүү, бир канча баскычтуу жана көп бөлүктүү бир тартиптин кокустан пайда болушунун мүмкүн эместиги апачык көрүнүп турат. Болгондо да, бул жерде айтылгандар белоктун түзүлүшү менен байланыштуу сансыз детальдардын эң жөнөкөйлөштүрүлгөн бир кыскача баяны гана. Белоктор жөнүндө жасалган тереңирээк изилдөөлөр бул молекулалардын мындан да комплекстүү өзгөчөлүктөрүн аныктоодо жана али белгилүү боло элек дагы көп тараптары бар. Бул чындык болсо жашоонун эң майда курулуш материалдарында дагы “кокустан пайда болуу” пикирине эч орун жок экенин анык көрсөтүүдө.
Белоктордун Төртүнчү Түзүлүшү: Татаал Белоктор
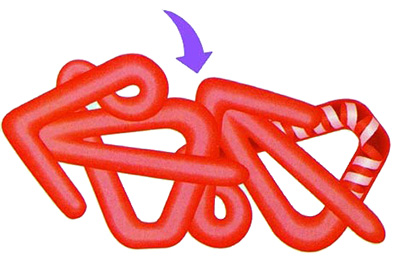
|
|
Proteinlerin içiçe girmiş telefon kordonları gibi oldukça kompleks bükülmeler yaparak birleşmeleri proteinlerin kuaterner yapılarını meydana getirir. |
Үстүндө көптөгөн телефон турган бир офис столун элестетиңиз. Столдогу бүт телефондордун шнурлары бир-бирине чаташып аралашат. Ал шнурларды карап кайсы шнурдун кайсы аппараттан чыкканын түшүнүү бир караганда мүмкүн болбойт. Белоктор да кээде чаташып жаткан ушундай телефон шнурлары сыяктуу өтө татаал бүктөлүшүп, бир-бирине уланышат.
Көптөгөн белоктор ушинтип уланган соң гана өз кызматын аткара ала турган абалга келишет. Бирок белоктор бир-бирине уланып ири молекулаларды пайда кылышы үчүн да өтө кылдат тең салмактуулуктар камсыз кылынышы зарыл. Эгер эки белок белок бириге турган болсо, экөөсүнүн тең формасы бир-бирине кол менен колкаптай дал келиши зарыл. Антпесе бир-бирине улана алышпайт. Белоктор биригиши үчүн талап кылынган мындай төп келүүчүлүккө баш катырма оюндарды мисал келтирүүгө болот. Бир эле бөлүктүн чыккан жери же оюктары туура келбесе, сүрөттү толуктай албайбыз. Белоктордо да жагдай ушундай. Бириге турган белоктордон бирөөсүнүн эле байланыш формасы ылайыктуу болбосо, ири молекула эч бир ишке жарабайт.16
|
|
Insulin molecule |
Мындан тышкары, татаал (бириккен) белоктор, денедеги кызматтарын аткара алышы үчүн, так керектүү санда биригиши шарт. Мисалы, «инсулин» гормонун карап көрөлү. Бул белок бирден көп аминокислота чынжырынын биригиши менен денедеги ашыкча шекерди кампалоо буйругунун берилишин уюштурат. Инсулиндин түзүлүшүндөгү бир туура эместик бул молекуланы ишке жараксыз кылып койот жана кишинин кант (диабет) оорусуна чалдыгышына себеп болот. Себеби инсулин өз кызматын жасабаганда денеге кирген шекерлер толук колдонулбастан жана муктаждык үчүн кампаланбастан денеден чыгарып салынат. Мунун натыйжасында болсо дененин иштеши учурунда талап кылынганда канда жана кампада шекер табылбай калат. Ошентип клеткалардын муктаждыгы болгон энергия камсыз кылынбай калат. Мунун аягы өлүм менен аяктайт.
Ушул сыяктуу, денебиздеги болжол менен эки жүз түрдүү клетканын эч биринде бир белоктун түзүлүшү жана формасында да эч бир ката болбошу зарыл. Мындай түзүлүш өтө улуу жаратуу натыйжасында гана болушу мүмкүн. Себеби бул түзүлүштүн ар бир баскычында эң акыркы баскычка, б.а. максатка жараша план түзүлөт жана ошого жараша иш-аракет жасалат. Бир белок түрү болгон, бөйрөк үстүндөгү бездер тарабынан чыгарылган адреналин гормону талап кылынган түзүлүштө болгондо гана булчуң, жүрөк жана кан клеткалары тарабынан таанылат жана ал клеткадагы иш-аракеттерди стимулдай алат. Мунун натыйжасында дененин физикалык жана материалдык коркунучтардан коргонушун камсыздай алат. Ошол сыяктуу денебизде кызмат кылган бүт фермент белоктору да өзгөчө формасы урматында гана клетка бөлүнүшүндө, энергия өндүрүүдө, молекула ташууда жана дагы көптөгөн иштерде кемчиликсиз кызмат көрсөтө алышат.
Учурдагы технологиялык мүмкүнчүлүктөр менен жандыктардын молекулаларын изилдеген биохимиктерди өтө таң калтырган бул молекулалар жөнүндө алынган ар бир жаңы маалымат бул теңдешсиз жаратууну жакшыраак көз алдыга тартып, кокустуктардын буларды түшүндүрүүдө канчалык акылсыз болуп калаарын көрсөттү. Эволюционисттердин мынчалык комплекстүү жана жогорку долбоорго ээ түзүлүштөрдү кокустуктар натыйжасында пайда болгон деп жакташы жана кокустуктарга жаратуучу бир кудайга ишенгендей ишениши – өтө маанилүү бир акылсыздыктын көрсөткүчү. Акылдуу, абийирлүү, чын пейилдүү адамдар гана чындыктарды көрө алышат. Бул чындык Куранда мындайча кабар берилет:
Силердин кудайыңар жалгыз Кудай; Андан башка Кудай жок; Ал Рахман, Рахим (кечиримдүү жана боорукер).
(Бакара Сүрөсү, 163)
|
|
Proteinlerin birbirleriyle birleşerek dev moleküller meydana getirebilmeleri için proteinlerin bir yap-boz oyunundaki parçalar kadar birbirlerine uyumlu olmaları gerekmektedir. |
Булактар
3. Prof. Dr. Ali Demirsoy, Kalıtım ve Evrim, Meteksan Yayıncılık, Ankara, 1995, Yedinci Baskı, s. 61

4. Prof. Dr. Ali Demirsoy, Kalıtım ve Evrim, Meteksan Yayıncılık, Ankara, 1995, Yedinci Baskı, s. 61

5. Fabbri Britannica Bilim Ansiklopedisi, cilt 2, Sayı 22, s.519

6.Vance Ferrell, Dna, Protein and Cells, Harvestime Books, 1996, s. 24

7. Walter T. Brown ,In the Beginning (1989)

8.Prof. Dr. Engin Gözükara, İnönü Üniversitesi Tıp Fakültesi Biyokimya Ana Bilim Dalı Başk., Biyokimya, Nobel Tıp Kitabevleri 1997, Üçüncü Baskı, Cilt1. s.123-124

9. P.A.Temussi et al., "Structural Characterization of Prebiotic Polypeptids", Journal of Molecular Evolution 7, (1976):105

10.Mere Creation, Edited By William A. Dembski, Intervarsity Press, Illinois, 1998, s. 125-126

11.Curtis Barnes, Invitation to Biology, Worth publishers, Inc, New York 1985, s. 49

12. Michael Behe, Darwin'in Kara Kutusu, Aksoy Yayıncılık, İstanbul, Haziran 1998, s. 259

13.Structure and Properties of Spider Silk, Endeavour, Ocak 1986, sayı:10, s.42

14.J.Watson (1976), The Molecular Biology of the Gene, 3rd edition, (Menlo Park, Calif:W.A.Benjamin), s.100)

15.Prof. Dr. Engin Gözükara, İnönü Üniversitesi Tıp Fakültesi Biyokimya Ana Bilim Dalı Başk., Biyokimya, Nobel Tıp Kitabevleri, 1997, Üçüncü Baskı, Cilt1., s. 157

16.Michael Behe, Darwin'in Kara Kutusu, Aksoy Yayıncılık, İstanbul, Haziran 1998, s.60
